Objetivos de aprendizaje
- Discutir como los cambios de concentración y permeabilidad iónica afectan el potencial de membrana en reposo mediante el uso de un simulador.
- Coordinar el análisis y la resolución de viñetas clínicas relacionadas con el potencial de membrana y el potencial de acción a través de la discusión grupal.
Resultado de aprendizaje
- Integra el concepto de potencial de equilibrio, potencial de membrana en reposo y potencial de acción mediante un software de ecuaciones Nernst/Goldman.
- Analiza como los cambios en la concentración y la permeabilidad iónica afectan el potencial de equilibrio, el potencial de membrana y el potencial de acción en situaciones clínicas.
Glosario de términos
Conductancia (G): Propiedad de la membrana celular que representa la facilidad con la que los iones pasan o atraviesan un segmento de la membrana celular.
Constante de longitud: Indica que distancia tendremos que alejarnos del sitio de máximo voltaje para encontrar que la señal decae hasta el 37% de su valor (figura 1 glosario).
Constante de tiempo: Indica el tiempo que una célula tarda en descargarse hasta el 37% del valor máximo que se alcanza cuando aplicamos un pulso de corriente (figura 1 glosario).
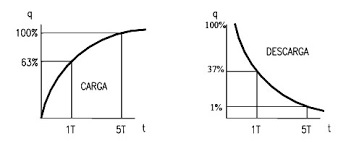
Figura 1 glosario. Se muestra la carga o despolarización de la membrana celular (izquierda) así como el decaimiento de esta desde el 100%, al 37 % y luego al 1%. Cuando la señal decae al 37% en función del tiempo, es constante de tiempo y cuando lo hace en función de la distancia, es constante de longitud.
Despolarización: Es el proceso mediante el cual una célula excitable cambia su potencial eléctrico, de negativo a positivo mediante el intercambio de iones y puede llegar a generar un potencial de acción.
Ecuación de Nernst: Ecuación utilizada para calcular el potencial de equilibrio de un ion que se encuentre en ambos lados de una membrana permeable para él
Ecuación de Goldman-Hodgkin-Katz: Ecuación utilizada para calcular el potencial de membrana al interior de una célula permeable a Na+, K+ y Cl-.
Equilibrio de Gibbs-Donnan: Se designa así al equilibrio que se produce entre los iones que pueden atravesar la membrana y los que no son capaces de hacerlo.
Ley de Ohm: Es la forma de calcular la relación entre voltaje, corriente y resistencia en un circuito eléctrico. La fórmula es: V = I x R, donde: V = voltaje, I = corriente, R = resistencia.
mM: Milimolar, es una medida de concentración de un soluto en una disolución (10-3 molar).
mV: milivoltios, es la unidad de medida de la tensión eléctrica equivalente a la milésima parte de un voltio.
nM: NanoMolar, es una medida de concentración de un soluto en una disolución (10-9 molar).
Período refractario absoluto: Intervalo de tiempo que ocurre después de que la membrana alcanza su nivel umbral y se lleva a cabo el potencial de acción, en este periodo es imposible excitar a la célula independientemente de la corriente de estimulación que se le aplique.
Período refractario relativo: Intervalo de tiempo que ocurre posterior al periodo refractario absoluto, en la cual es posible desencadenar el potencial de acción, pero se necesita de la aplicación de estímulos más grandes que los requeridos normalmente para alcanzar el umbral.
Potencial de acción: Impulso eléctrico transitorio y regenerativo en el cual el potencial de membrana aumenta rápidamente volviéndolo más positivo comparado con su estado de reposo.
Potencial de equilibrio para un ion: Diferencia del potencial eléctrico a través de la membrana celular que equilibra exactamente el gradiente de concentración de un ion.
Potencial de membrana en reposo: Diferencia de voltaje a través de la membrana, generado por la permeabilidad y la diferencia de concentraciones de ciertos iones en una célula que no se encuentra activa.
Umbral: Punto crítico o limite en el que un estímulo alcanza una magnitud suficiente para desencadenar una respuesta.
Voltaje: Magnitud que establece la diferencia del potencial eléctrico entre dos puntos.
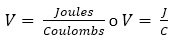
- Introducción
Potencial de equilibrio
Toda célula está delimitada por una membrana plasmática formada por una bicapa de lípidos, lo que le confiere un carácter hidrofóbico. No obstante, la membrana es semipermeable a una amplia variedad de moléculas, lo que resulta en una diferencia en la composición del citoplasma y el medio extracelular. De entre todas las moléculas, los iones resultan ser de vital importancia para múltiples funciones celulares. Los más abundantes son el Na+, K+, Ca2+ y Cl–, cuyos valores fisiológicos en el humano se indican en la tabla 1.
| Ion |
Concentración intracelular |
Concentración extracelular |
| Na+ |
12 mM |
145 mM |
| K+ |
140 mM |
4 mM |
| Ca++ |
100 nM |
1.5 mM |
| Cl– |
4.2 mM |
123 mM |
Tabla 1. Concentraciones típicas de los principales iones en el medio intracelular y extracelular en humanos.
Esta diferencia en las concentraciones iónicas condiciona una diferencia entre las cargas a ambos lados de la membrana, las mismas que tratarán de igualarse (equilibrio de Gibbs-Donnan). Bajo ciertas condiciones, la membrana permite el paso de algunos iones, lo que genera un flujo de cargas que depende de la permeabilidad relativa de la membrana a cada ion. Al pasar los iones a favor de su gradiente de concentración (de donde hay más a donde hay menos) se genera una diferencia de potencial eléctrico a través de la membrana, llamado potencial de membrana (medida en milivoltios o mV). Es de crucial importancia comprender que dicho potencial de membrana será determinado solo por las concentraciones iónicas a cada lado de la membrana y por la permeabilidad de la misma membrana a cada ion.
Antes de entender cómo se genera el potencial de la membrana, debemos comprender lo que es el potencial de equilibrio. En la figura 1 vemos dos momentos: 1) estado de inicio y 2) en equilibrio. En el estadio inicial, tenemos dos compartimentos, adentro y afuera de la célula, y podemos ver que afuera de la célula hay mucho Na+ y Cl–, en este caso, la membrana es IMPERMEABLE al Cl– pero PERMEABLE al Na+, porque existen canales de Na+ que permitirán que éste difunda hacia adentro de la célula (a favor del gradiente de concentración). Y así el Na+, comenzará a difundir hacia adentro de la célula, pero llegará el momento en donde se detendrá su difusión porque las cargas del Cl– se encuentran atrayendo al Na+ para que regrese al medio extracelular, en este momento el Na+ ha llegado a su POTENCIAL DE EQUILIBRIO.
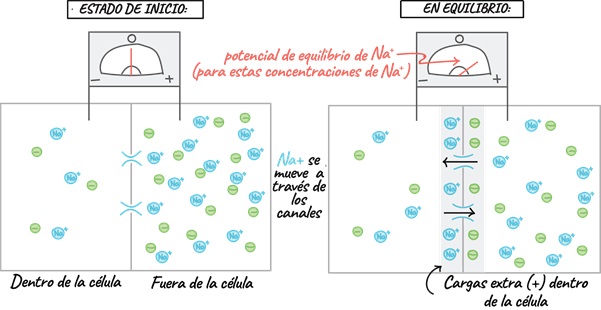
Figura 1. Se esquematiza el potencial de equilibrio para el Na+, logrado a través de la difusión de este por canales iónicos específicos y la fuerza quimioatrayente del Cl–.
Este equilibrio está descrito por la ecuación de Nernst, y se aplica para cada ion difusible a través de la membrana celular:
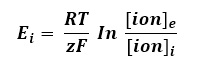
Dónde:
Ei= Es el potencial de equilibrio del ion X [V]
R= constante de los gases (8.314 J/mol K)
T = temperatura absoluta [K]; y ya que K = 273.15 + °C, a T corporal K=310.15 K
z = valencia del ion (-1) para aniones y (+1) para cationes monovalentes
F = constante de Faraday (96485 C/mol)
[ion]e = concentración extracelular del ion
[ion]i = concentración intracelular del ion
Potencial de membrana en reposo.
Considerando que la membrana plasmática es principalmente permeable al K+, debido a la presencia de canales de fuga de K+ que permiten que éste salga de la célula cuando se encuentra en reposo, se puede simplificar el potencial de membrana en reposo como el potencial de equilibrio de K+. Usando la ecuación de Nernst, usando los valores que hemos visto en esta práctica, tenemos:
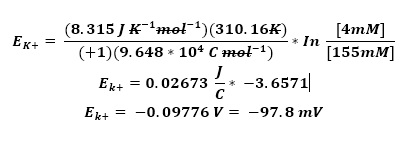
El potencial de equilibrio para el K+ es -93 mV y a este voltaje se acercará el potencial de membrana en reposo. Sin embargo, el potencial de membrana en reposo de las células es diferente, ya que también las células también son permeable as a otros iones como el Na+ y Cl–. Por esto usamos la ecuación de Goldman–Hodgkin–Katz:
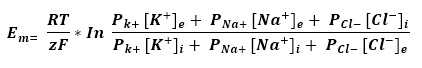
Donde Em es el potencial de membrana en reposo y P equivale a la permeabilidad relativa de la membrana a cada ion. Nótese que dado que el Cl– tiene carga negativa, los valores de concentración intra- y extracelular cambian de lugar para poder usar el mismo valor de RT/zF. Considerando que la permeabilidad relativa respecto a K+ del Na+ es de 0.04 y de Cl– es de 0.45, a temperatura corporal y las concentraciones indicadas en la tabla 1, el potencial de membrana en reposo es aproximadamente -70 mV. La permeabilidad de la membrana a los diferentes iones está dada por la existencia de proteínas transmembranales llamadas canales iónicos. Al abrirse, los canales iónicos permiten el paso selectivo de iones a favor de su gradiente electroquímico.
Potencial de acción
Algunos tipos de células tienen la capacidad de cambiar el potencial de membrana en reposo que es negativo, y generar potenciales positivos y transientes que conocemos como potenciales de acción. Los potenciales de acción son cambios estereotípicos, abruptos y transitorios en el potencial de membrana que ocurren en células excitables, llamadas así porque pueden responder ante la estimulación directa con una corriente eléctrica (por ejemplo, neuronas, células musculares y células endocrinas). Los potenciales de acción desempeñan un papel central en la comunicación de celular, siendo la base de la propagación de señales en neuronas y activando diversos procesos intracelulares como la contracción muscular y la liberación de insulina en las células beta del páncreas. Numerosos y brillantes científicos aportaron ideas novedosas que fueron consolidando la disciplina que hoy en día conocemos como electrofisiología. En la página http://www.facmed.unam.mx/historia/ se puede consultar un interesante recorrido por las ideas y descubrimientos que llevaron a nuestro entendimiento actual de la fisiología de las células excitables.
El potencial de acción se debe a que existe un estímulo específico que abre canales de Na+ dependientes de voltaje, hasta que son tantos que el Na+ comienza a difundir desde afuera de la célula al interior, haciendo el citosol más positivo, es por ello por lo que el potencial de acción se acerca al potencial de equilibrio del Na+, porque con la apertura de estos canales, se aumenta su permeabilidad y el Na+ busca llegar a su equilibrio. El potencial de acción pasa por distintas fases dependiendo del tipo de célula excitable (Figura 2). En cada fase, la membrana celular cambia su permeabilidad abriendo y cerrando canales iónicos para que éstos fluyan, regresando al potencial de membrana en reposo al terminar estos cambios.
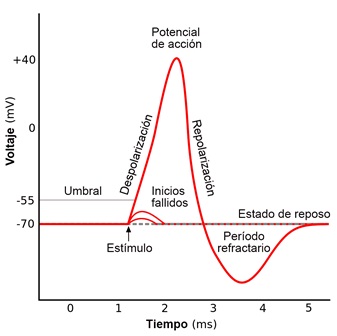
Figura 2. Potencial de acción típico de una neurona. El potencial de acción en una neurona tiene tres fases, 1. Despolarización, 2. Repolarización, 3. Hiperpolarización. La fase de despolarización consta de un incremento rápido y homogéneo del potencial de membrana en reposo (-65 mV) hasta un valor positivo máximo (entre +10 a +40 mV), el fenómeno responsable de esta fase es el aumento en la conductancia de la membrana celular al Na. La fase de repolarización consta de un descenso desde el punto máximo de la despolarización y hasta el regreso al potencial de membrana en reposo. La fase de hiperpolarización puede dar lugar a un voltaje más negativo que el potencial de membrana en reposo. El fenómeno responsable de las fases de repolarización e hiperpolarización es el aumento en la conductancia de la membrana celular al potasio.
Para iniciar el potencial de acción, se tiene que generar un estímulo que alcance el umbral y en ese momento se genere la fase de despolarización (canales de Na+ abiertos), llegando al sobretiro que es la parte más elevada del potencial (canales de Na+ inactivos), continuando la repolarización (canales de K+ abiertos), regresando al estado de reposo. El intervalo posterior al inicio de un potencial de acción en el que es imposible o resulta más difícil producir una segunda espiga se denomina período refractario. El periodo refractario consta de dos fases, el periodo refractario absoluto y el relativo. El primero (absoluto) abarca desde el inicio del potencial de acción hasta casi el final de la repolarización, en esta fase es imposible desencadenar un segundo potencial de acción, independientemente de la intensidad o duración del estímulo aplicado. El periodo refractario relativo abarca el final de la repolarización y la hiperpolarización, en este, el estímulo necesario para que se lleve a cabo un nuevo potencial de acción deberá ser de mayor intensidad y duración que el estímulo que provoco el primer potencial de acción.
- Actividades en la sesión
Actividad 1. Predicción de cambios en el potencial de membrana
Materiales: Requieres una computadora por equipo de 3 personas con el programa ya descargado para la clase. Formula hipótesis en función de los cambios de concentraciones iónicas, temperatura y compruébalas en el software.
Indicaciones para descargar el Software
1) Descarga en tu computadora el programa Simulador de ecuaciones Nernst/Goldman, desarrollado por la Universidad de Arizona y disponible para Windows o Mac en el siguiente enlace (te recomendamos dar click en “Download Standlone Flash Version”):
https://www.azps.life/home/2016/4/28/teaching-spotlight-nernstgoldman-simulator
O puedes entrar a descargarlo desde el drive del departamento en:
https://drive.google.com/file/d/1SRHf796wcYYI4cTveEK-BuCvYBl2_Y2s/view?usp=drive_link
Recuerda que este paso debes hacerlo con anticipación porque te pediremos acceso para registrarte. Se descargará un archivo con terminación .zip/.exe.
2) Se abrirá una pantalla inicial de la Universidad de Arizona y solo debes dar clic en el centro para ingresar al Software.
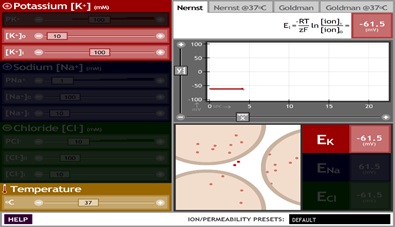
En esta pantalla se pueden observar varios controles:
Del lado izquierdo:
a) Barras deslizables (rojas, azules y verdes) que permiten controlar las permeabilidades (Px, visibles cuando se selecciona la ecuación Goldman) y las concentraciones intra y extracelulares ([x]i y [x]0, respectivamente) de los iones potasio, sodio y cloro. b) Barra deslizable (amarilla) que permite controlar la temperatura.
Del lado derecho:
a) Pestañas superiores: permiten seleccionar si el simulador funciona con la ecuación de Nernst o la ecuación de Goldman, y si se da la opción a variar la temperatura o se toma un valor fijo de temperatura a 37 °C. b) Ecuación que se usa para correr la simulación con la pestaña seleccionada. c) Panel de en medio: gráfica que muestra el potencial de membrana en función del tiempo, con los parámetros estipulados. Nótese que se puede tener control de la escala en los ejes X y Y (con unidades en segundos y mV, respectivamente). También puede pausarse para observar con detenimiento los cambios. d) Panel inferior izquierdo: animación que ejemplifica la concentración de iones dentro y fuera de las células (no intenta demostrar el movimiento relativo de las partículas). e) Panel inferior derecho: muestra los valores calculados del potencial de equilibrio con las concentraciones y temperatura elegidos. f) Lista desplegable inferior: permite cambiar los valores predeterminados por los correspondientes a cuatro preparaciones experimentales típicas (célula genérica, músculo esquelético, axón de calamar y eritrocito).
Desarrollo de la práctica:
Formen equipos para resolver los siguientes problemas. Cada equipo con base en el conocimiento previo de la ecuación de Nernst y la generación del potencial de membrana hará una hipótesis de cómo se modificará el potencial de membrana en las siguientes condiciones:
- Cuando la célula sólo es permeable al potasio, ¿qué pasará con el potencial si…?
A) Duplicas las concentraciones de Na+ extracelular.
B) Igualas la concentración intracelular y extracelular de K+.
D) Disminuyendo la concentración de potasio extracelular.
E) Disminuyendo la concentración de potasio intracelular.
C) Aumentas la temperatura.
- Cuando la célula es permeable al potasio, sodio y cloro, ¿qué pasará con el potencial si…?
A) Aumentas las concentraciones de sodio extracelular al doble.
B) Aumentas la permeabilidad al sodio.
C) Aumentas la permeabilidad al potasio.
D) Aumentas la permeabilidad al cloro.
E) Aumentas la permeabilidad al sodio y al cloro simultáneamente.
- Después de hacer una hipótesis para cada una de las preguntas previas, utilizarán el simulador en la modalidad Goldman para realizar experimentos en los que sistemáticamente se obtenga y grafique el valor de potencial de membrana en función de modificar:
A) La concentración extracelular de cada uno de los iones.
B) La concentración intracelular de cada uno de los iones.
C) La temperatura.
D) Las permeabilidades de los iones.
Con los datos y gráficas obtenidas, contrasten los resultados obtenidos con sus hipótesis previas y hagan un reporte de práctica (se recomienda hacer un diagrama metodológico).
Actividad 2. Viñetas clínicas
Instrucciones: Antes de comenzar a resolver las preguntas, lee cuidadosamente cada viñeta e investiga las palabras que desconozcas. Posteriormente, vuelve a leer las viñetas y responde en equipo las preguntas que aparecen en cada una.
Viñeta 1. Acude a usted un paciente masculino de 2 años y 10 meses, sano desde el nacimiento quien en los últimos 3 meses ha presentado 2 cuadros de dolor abdominal, debilidad, cansancio, dolor en las extremidades inferiores, hipotonía y debilidad generalizada que imposibilita la marcha y la sedestación. Como único antecedente, el paciente ingirió una alta cantidad de carbohidratos (pastel y helado) el día anterior a los síntomas. Se le tomaron muestras, obteniendo como único valor alterado el potasio sérico: 1.9 mmol/L (valores normales entre 3.5 – 5.0 mmol/L).
Puedes ayudarte del simulador para razonar de una mejor manera la viñeta clínica.
- Los resultados de laboratorio mencionados en el caso, ¿representan al líquido intra o extracelular?
- ¿Consideras que los valores de potasio sérico tienen relación con el cuadro clínico del paciente?
- ¿Cómo contribuye el potasio al potencial de equilibrio de la membrana celular?
- ¿Qué síntomas esperarías encontrar en un paciente con los niveles elevados o disminuidos de potasio?
Comentario: Para que exista un potencial eléctrico en la membrana celular es fundamental el paso de iones del espacio intracelular al extracelular y viceversa, a través de canales transportadores de iones. Esto es necesario para que la célula pueda recibir y transmitir impulsos hacia otras células vecinas y así compartir información. Cuando uno de dichos canales se ve alterado, se producen enfermedades denominadas canalopatías. Al dispararse un potencial de acción, ingresan numerosas cantidades de Na+ al espacio intracelular, por lo que para regresar a los valores de potencial de membrana a sus valores negativos en reposo es necesario que los canales de potasio dependientes de voltaje se activen para permitir el paso de K+ al espacio extracelular y así disminuir el voltaje de la membrana celular hacia los valores de iniciales de reposo. El paciente en cuestión padece una canalopatía llamada parálisis periódica hipocalémica familiar, en la cual los canales de salida de potasio dependientes de voltaje se ven alterados.
- ¿Qué esperas que suceda en el potencial de membrana en reposo en pacientes con esta enfermedad?
- ¿Qué cambios se esperarían en el umbral para desencadenar un potencial de acción?
Si deseas conocer más a detalle el caso clínico de la actividad, puedes consultar el artículo completo en las referencias (5)
Viñeta 2. Llega a urgencias un paciente masculino de 48 años con deshidratación y dolor abdominal. Después de realizar el interrogatorio y la exploración física, se solicitan laboratorios de acuerdo con la sospecha diagnóstica. Los resultados de los laboratorios (glucosa 268 mg/dl, bicarbonato 12 meq/L, pH 7.2 y una cetonemia moderada) confirman el diagnóstico de cetoacidosis diabética, una complicación aguda de la diabetes mellitus tipo 2, por lo que se inicia tratamiento con insulina y soluciones intravenosas (para corregir la deshidratación). Después de algunas horas, mejora la hiperglucemia y la acidosis, pero el paciente empieza a presentar debilidad muscular e hiporreflexia. Adicionalmente, el electrocardiograma presenta anomalías y se detecta distensión abdominal con disminución de ruidos peristálticos. Entonces, uno de los residentes explica que la insulina es una hormona que, además de permitir la entrada de glucosa a las células, favorece el movimiento de potasio del líquido extracelular al intracelular. Se miden los electrolitos séricos y se encuentra hipopotasemia grave, por lo que se inicia tratamiento con cloruro de potasio (KCl) intravenoso.
Con ayuda del simulador, responde las siguientes preguntas. Selecciona la ecuación de Goldman a 37 °C y los valores de célula genérica.
- ¿Qué cambio genera en el potencial de membrana una disminución del potasio extracelular? ¿Se vuelve más negativo (hiperpolarización), menos negativo (despolarización) o no se modifica? Justifica tu respuesta. (Al utilizar el simulador, puedes disminuir la [K+]0 a 1 mM.)
- La insulina administrada no solo cambió la concentración extracelular de potasio, sino que aumentó la permeabilidad al potasio de la membrana celular. ¿Qué efecto tiene en el potencial de membrana el incremento de la permeabilidad al potasio? ¿Lo hace más o menos negativo? ¿Lo aleja o acerca al EK? Justifica tu respuesta. (En el simulador, puedes incrementar por tres la permeabilidad para observar el cambio.)
- Ahora prueba disminuir la concentración de potasio extracelular a 1 mM y aumentar su permeabilidad por tres de manera simultánea, lo cual es una aproximación de lo que ocurrió con el paciente de la viñeta. ¿Cuánto cambió el potencial de membrana con respecto al basal? ¿La magnitud del cambio fue mayor que antes? ¿Por qué?
Comentario: la hipopotasemia hiperpolariza a las células. Esto se debe a que el incremento en el gradiente de concentración de potasio vuelve más negativo su potencial de equilibrio (EK), como se deduce de la ecuación de Nernst. A su vez, el EK es el que tiene más influencia sobre el potencial de membrana en reposo, como se infiere a partir de la ecuación de Goldman. Si se incrementa la permeabilidad al potasio, esta influencia aumenta todavía más. La combinación de estos factores afecta a las células excitables, disminuyendo su excitabilidad. Las consecuencias son principalmente cardíacas (arritmias), musculares (debilidad, hiporreflexia) e intestinales (íleo paralítico). Por ello, antes de dar grandes cantidades de insulina a un paciente, se debe corroborar la concentración de potasio sérico, calcular la magnitud esperada de su descenso y, si está indicado, administrar KCl de manera oportuna.
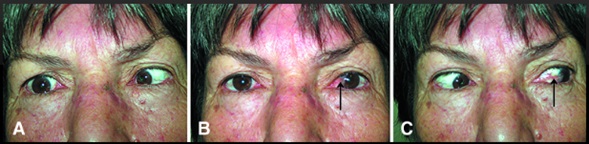
Viñeta 3. Se presenta al servicio, un paciente masculino de 39 años, que presenta imposibilidad para caminar y mover los brazos, fuerza muscular 0/5 en escala de Daniels, arreflexia osteotendinosa en miembros inferiores e hiporreflexia en miembros superiores, hipotonía muscular generalizada, sensibilidad normal, hallazgos de laboratorio típicos de un síndrome de Guillain-Barré. El paciente refiere enfermedad gastrointestinal de una semana de evolución.
1) ¿Qué esperarías encontrar en la conducción nerviosa de los miembros inferiores de este paciente?
2) ¿Por qué piensas que los miembros inferiores están más afectados que los superiores?
Comentario: El Síndrome de Guillain Barré es una serie heterogénea de neuropatías periféricas mediadas inmunológicamente. El hallazgo común es la polirradiculopatía de evolución rápida, que se manifiesta posteriormente a un suceso disparador, que con frecuencia es un proceso infeccioso. Se manifiesta generalmente con una parálisis motora simétrica con o sin afectación sensorial y autonómica. Su diagnóstico se basa en el examen electrodiagnóstico, análisis de LCR y evolución clínica. El trastorno suele aparecer unos días o semanas después de que la persona haya tenido síntomas de infección viral respiratoria o intestinal, en algunas ocasiones, el embarazo, cirugías o las vacunas pueden desencadenar el síndrome.
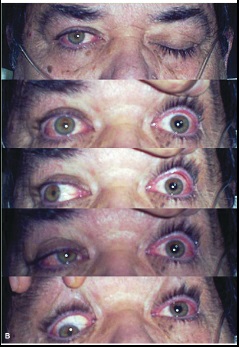
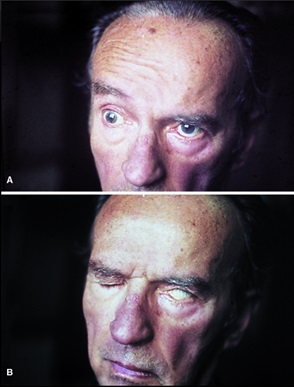
Viñeta 4. Paciente mujer de 42 años con antecedentes de poliartralgias y tendinitis con anticuerpos antinucleares positivos, tratada durante un año con AINE con posterior mejoría del cuadro y negativización de los anticuerpos. Había presentado varios episodios de visión borrosa autolimitados, atribuidos a desprendimiento posterior de vítreo y varios cuadros vertiginosos de corta duración, habiendo sido estudiada por Neurología sin encontrar causa aparente. Acude al Servicio de Urgencias con un cuadro clínico de disartria y afasia de expresión sin otra sintomatología, que inicia de forma brusca mientras se encontraba trabajando. La paciente refiere, además, astenia y adinamia de cuatro meses de evolución. Al examen físico se evidencia dificultad para la expresión y dificultad para articular palabras.
1) ¿Cuál es tu primera impresión diagnóstica?
2) Investiga ¿qué son los anticuerpos antinucleares? Y ¿en qué enfermedades se presentan?
Después de diversos estudios incluidos una resonancia magnética en la cual se evidencia lesión de sustancia blanca en centro semioval izquierdo de posible origen inflamatorio-desmielinizante, se integra el diagnóstico de esclerosis múltiple.
- Investiga ¿qué es la esclerosis múltiple?
- ¿Cómo explicas el cuadro clínico que presentó la paciente?
- ¿Se encontrarán alterados el potencial de membrana y/o de acción en las neuronas de esta paciente?
- Discute tus respuestas en el grupo.
REFERENCIAS
- Boron & Boulpaep. Fisiología Médica. 3ª Edición. Madrid: Elsevier. 2017.
- Guyton & Hall. Tratado de Fisiología Médica. 13 ª Edición. España: Elsevier. 2016.
- Hille, Bertil. (1992) Ionic Channels of Excitable Membranes. Second Edition. Sinauer Associates, Massachusetts, USA.
- Kandel, E; Schwartz, J y Jessell, T. (2000). Principios de Neurociencia. Cuarta edición. Editorial McGraw Hill Interamericana. Madrid. España. 2000.
- Vélez MM, Carrizosa J, Cornejo W. (junio 2002). Parálisis periódica hipocalémica familiar (PPHF): Reporte de un caso y revisión del tema. IATERIA, 15, 114-120.
- Goldman L. (1961). The effect of stretch on the conduction velocity of single nerve fibers in Aplysia. Journal of cellular and comparative physiology, 57, 185–191. https://doi.org/10.1002/jcp.1030570306
- Moreno Gómez, M. del M., & García Romanos, F. (2021). Clinical case: atypical presentation of multiple sclerosis in a 42-year-old patient. Atencion Primaria Practica, 3(1), 100082. https://doi.org/10.1016/j.appr.2021.100082

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional
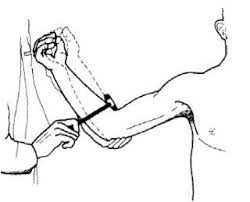 Reflejo bicipital: Se sujeta el codo del participante a 90 grados de flexión con el brazo ligeramente en pronación, y se procede a percutir el tendón a través del pulgar y la respuesta normal es la flexión del codo. Se debe realizar de manera bilateral.
Reflejo bicipital: Se sujeta el codo del participante a 90 grados de flexión con el brazo ligeramente en pronación, y se procede a percutir el tendón a través del pulgar y la respuesta normal es la flexión del codo. Se debe realizar de manera bilateral.






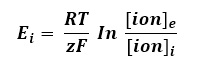
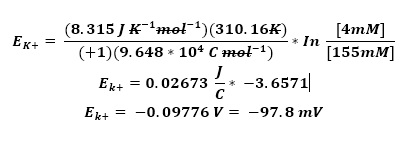
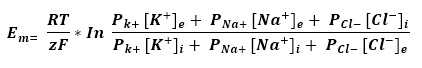




Comentarios recientes