Fisiología de la actividad eléctrica del cerebro: electroencefalografía
Resultado de aprendizaje
El estudiante:
Analiza los fundamentos fisiológicos básicos de la electroencefalografía.
Identifica los principales tipos de ritmos que conforman el electroencefalograma (EEG).
- Introducción
En 1875, Richard Caton, publicó la primera evidencia conocida sobre las oscilaciones eléctricas en el cerebro. De sus resultados realizados en modelos animales reportó: «Existen corrientes débiles de direcciones variables que pasan a través del multiplicador cuando los electrodos se colocan en dos puntos de la superficie externa, o un electrodo en la materia gris y otro en la superficie del cráneo«. Además, «la corriente por lo general está en constante fluctuación; el índice de oscilación es generalmente pequeño … En ocasiones, se observan grandes fluctuaciones, que en algunos casos coinciden con los movimientos musculares o cambios en el estado mental del animal». Los primeros registros en humanos fueron reportados por Hans Berger en 1929 y es por esto por lo que se le conoce como el padre de la electroencefalogafía (Ahmed and Cash 2013).
¿En dónde se generan estas oscilaciones en el potencial eléctrico?
Cualquier corriente transmembranal genera una contribución al potencial eléctrico local extracelular; sin embargo, la dimensión de la contribución depende de la intensidad y duración de la corriente. Así, el potencial local de campo medido en un punto va a estar determinado principalmente por los flujos de corriente a través de las membranas de las células más cercanas. Existen múltiples contribuciones a la corriente extracelular provenientes de: 1) el intercambio de información axón-dendritas “actividad sináptica” (en general se acepta que este es el principal contribuyente a las oscilaciones observadas en un registro de EEG (Schomer and Da Silva 2018)); 2) corrientes generadas por potenciales de acción; 3) corrientes intrínsecas u oscilaciones espontáneas en el potencial de membrana de las células; 4) sinapsis eléctricas; 5) fluctuaciones lentas en el potencial eléctrico de células gliales.
En resumen, el electroencefalograma es el resultado de la suma de los potenciales eléctricos locales, que son básicamente despolarizaciones e hiperpolarizaciones a través de las membranas neuronales. Los factores que determinan que un potencial sea registrado en la superficie dependerá de su voltaje, grado de sincronía en las descargas, organización anatómica de las células involucradas, área cortical involucrada, sitio de participación cortical respecto a las circunvoluciones, distancia hacia los electrodos, elección de los montajes de los electrodos, y la resistencia de los electrodos.
El intercambio de información entre las células del sistema nervioso se da por medio de corrientes eléctricas. En conjunto, esta actividad neuronal da origen a variaciones del potencial eléctrico en el espacio extracelular, variaciones en espacio y tiempo que pueden ser registradas y estudiadas para caracterizar sistemas neuronales. Estas oscilaciones en el potencial eléctrico local se han categorizado en diferentes bandas de frecuencia bien definidas (ritmos) que van aproximadamente desde 0.05 Hz hasta 500 Hz (en la Fig. 1 se ejemplifican las bandas de mayor uso en la clínica).
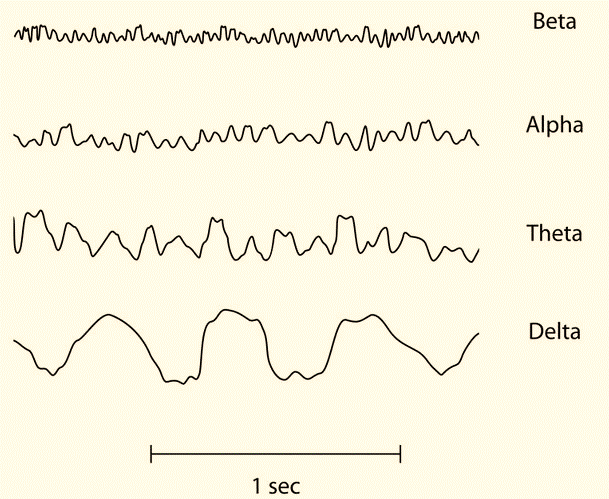
Fig. 1. Ritmos clásicos que se evalúan en un EEG en la clínica.
Diferentes ritmos se han sido asociado a la activación de redes locales de neuronas ligadas transitoriamente por conexiones dinámicas reciprocas. A estas redes se les denomina ensambles neuronales y dentro del cerebro, se piensa que la computación de todo acto cognitivo reside en el surgimiento de un ensamble neuronal específico (Varela, Lachaux et al. 2001, Barrett 2013). Al efectuar un electroencefalograma (EEG), los electrodos se colocan en lugares estándares y se organizan en diferentes montajes que permiten enfatizar diferentes características de las oscilaciones normales o patológicas. En el registro se obtienen una variedad de ondas diferentes para cada derivación (Roy 2017). Cada derivación del EEG representa la diferencia de potencial a lo largo del tiempo, registrada entre dos electrodos. Para fines de aplicación clínica, se consideran básicamente cinco ritmos: alfa, beta, theta, delta y gamma, a continuación, describiremos brevemente las características de uno de ellos (Barrett 2013, Koeppen and Stanton 2017, Rhoades and Bell 2018).
- Alfa (8 a 13 Hz; y bajo voltaje con amplitudes medias entre 30 y 50 µV)
El ritmo Alfa aparece cuando el sujeto está relajado en estado de vigilia y con los ojos cerrados. Es bloqueado o atenuado por la apertura de ojos y el esfuerzo mental, tal como hacer cálculos o concentrarse en una idea. Es por ello por lo que parece indicar el grado de activación cortical; mientras mayor sea la activación menor la actividad alfa. Las ondas alfa tienen mayor expresión en ambas regiones occipitales y frontales, con un campo de distribución que alcanza también zonas parietales y temporales posteriores. La mayoría de los sujetos normales presentan una asimetría del ritmo alfa, a menudo, la amplitud es mayor en el hemisferio derecho. En niños se puede registrar desde los 6 años, pero a los diez ya está perfectamente establecido.
- Beta (13 a 30 Hz y voltaje <20 µV).
Se observa en individuos despiertos, alertas y con los ojos abiertos, este ritmo es dominante si se encuentra en actividad mental y preferentemente se observa en regiones anteriores (frontales). Su distribución es fronto-central y puede haber reactividad ante estímulos táctiles y actividad motora de las extremidades contralaterales. Puede estar ausente o reducido en áreas con daño cortical y ser acentuado por drogas hipnóticas o sedantes.
- Theta (4 a 8 Hz; con mayor amplitud >30 µV).
Se registra en sujetos durante el sueño, principalmente el sueño MOR (Movimientos Oculares Rápidos). El ritmo theta no se ve en un adulto despierto, pero es normal en niños despiertos hasta la adolescencia. Su distribución preferentemente está en las regiones de los lóbulos temporales. Algunos investigadores separan esa banda de frecuencias en dos componentes, la actividad Theta baja (4 – 6 Hz) correlacionada con un estado de vigilia disminuida y somnolencia aumentada, y la actividad Theta alta (6 – 8 Hz) la cual se ve aumentada durante tareas que involucran a la memoria de trabajo.
- Delta (entre 0,5 y 4 Hz; y un voltaje muy alto hasta 100 – 200 µV).
El ritmo Delta es el ritmo dominante en las etapas 3 y 4 del sueño, pero no se ve en el adulto consciente. Tiende a tener la mayor amplitud de todas las ondas componentes del EEG. Su aparición en estado de vigilia representa una patología. En etapas pediátricas puede presentarse y se considera un signo del grado de madurez de la corteza cerebral. En algunas ocasiones los artefactos causados por los movimientos musculares pueden producir ondas en la misma banda de frecuencia.
- Gamma (entre 30 y 50 Hz).
Puede ser asociado con la actividad mental superior, incluyendo percepción y conciencia y desaparece bajo anestesia general. Una sugerencia es que el ritmo Gamma refleja la actividad mental envuelta en la integración de varios aspectos de un objeto (color, forma, movimiento, etc) para formar una imagen coherente.
Al hacer un análisis básico del electroencefalograma se busca identificar visualmente los cambios a lo largo del tiempo de la frecuencia, amplitud, fase, y morfología de las ondas registradas. En particular se pone atención a:
- Patrones (amplitud, frecuencia, morfología, duración, sincronia) de acuerdo con la edad.
- Patrones de acuerdo con el estado de conciencia, vigilia, sueño, coma, etc.
- Distribución topográfica.
- Reactividad ante diferentes manobras de activación.
- Organización de otros grafoelementos normales (Ondas V, ondas lambda, complejos K, husos de sueño).
- Grafoelementos anormales y condiciones desencadenantes.
- Artefactos (potenciales miogénicos, movimientos de la lengua, movimientos de los ojos, electrodos, ruido eléctrico de 60 Hz, etc).
El uso cada vez más extendido de computadoras permite el análisis cualitativo de actividad electroencefalográfica, así como la representación compactada por bandas de frecuencia o su presentación topográfica a colores en un esquema de la superficie de la cabeza. En forma simplificada el principio se basa en considerar a la actividad eléctrica cortical como una mezcla de fluctuaciones de voltaje sinusoidales y rítmicas que cubren un amplio rango de frecuencias. Esto se denomina banda de frecuencia o espectro de frecuencia. El espectro de frecuencia se puede descomponer en un número de ondas sinusoidales separándolas por sus diferentes frecuencias, amplitudes y valores de fase. Para hacer el análisis espectral se emplea clásicamente un método conocido como análisis de series de Fourier.
- Metodología
Materiales
- Electrodos de copa de oro
- Pasta conductora Ten 20
- Algodón y alcohol
- Isopos
- Silla
- Tela quirúrgica o sanitas
- Tijeras
- Sistema de registro Cadwell
- Actividades en la sesión
Actividad 1. Colocación de los electrodos y preparación del programa de registro.
Se realiza la distribución acorde al sistema internacional 10/20 en el cuero cabelludo. Como se muestra en la figura 2.
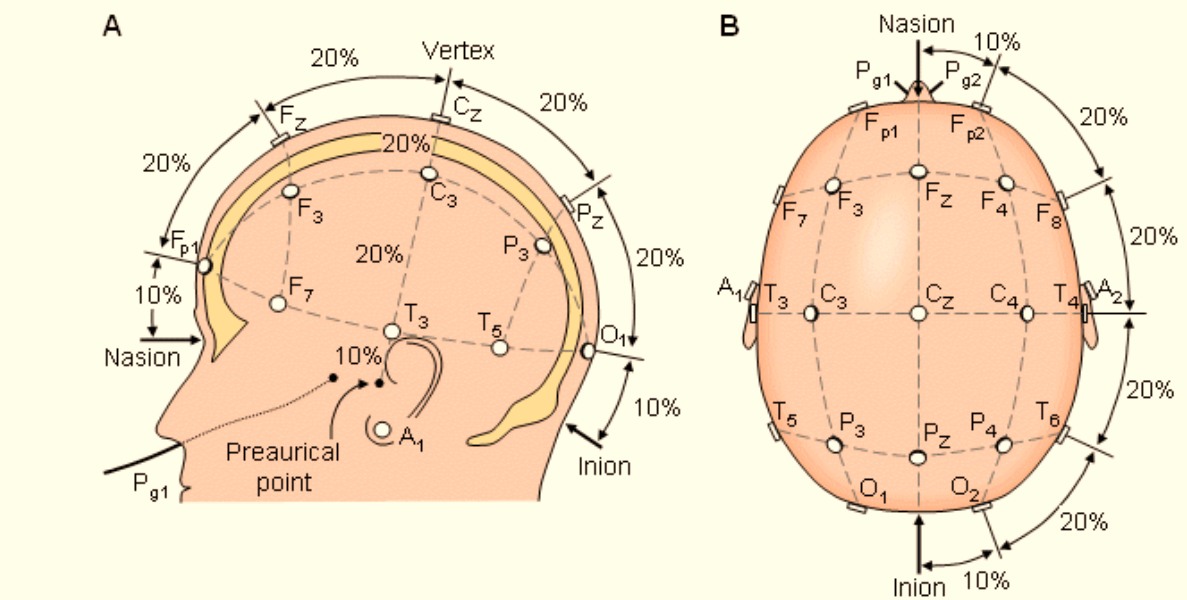
Fig. 2. Colocación de los electrodos según el sistema 10-20. A) vista lateral y B) vista superior. F = Frontal, C = central, P = Parietal, O = Occipital, A = Auricular.
Instrucciones para colocar los electrodos1:
1.- Obtenga las siguientes medidas: Inión–nasión cm (pasando por el vértex.) Perímetro cefálico: ___ cm Trago-trago: ____cm (depresión inmediata por delante del pabellón auricular)
2.- Coloque el electrodo central Cz a la mitad de la distancia entre inión y nasión (50 %) y a la mitad de la distancia trago a trago.
3.- Medir el 20% de distancia inión-nasión hacia delante de Cz en la línea media colocar Fz y en lado posterior Cz, así completara línea media.
4.- Seguir con el eje coronal de trago a trago.
5.- Completar con electrodos frontales F3, F4 y P3, P4.
6.- Ahora se mide la circunferencia de la cabeza, pasando la cinta métrica por T4 y T3. En este plano y al 20 y 40% de la medida de la circunferencia y por delante de T4 se localiza F8 y FP2, de igual forma en lado izquierdo se localizarán F7 y FP1. Pasar por atrás de T4 también al 20% y 40% de la medida de la circunferencia colocar T6 y 02 y del lado izquierdo T5 Y 01, hasta completar el montaje.
7.- Coloque referencias en mastoides o pabellón auricular A1 y A2.
8.- Conecte los electrodos al equipo de registro (Amplificador Easy III, Cadwell) en las entradas correspondientes para cada electrodo. Tener cuidado de no doblar los electrodos, dado que son cables muy finos y se pueden romper fácilmente.
9.- En el escritorio elija el programa Cadwell, e ingrese los datos del participante, al finalizar elija Start Recording con opción de EEG.
10.- Verifique que su impedancia sea menor a 5 K. (Figura 3).
11.- Se recomienda utilizar una sensibilidad de 7.1 µV/mm y una velocidad de 1 segundo/división.
1Nota: Una vez ubicada la región, tome un hisopo y divida a la mitad el cabello, limpie el área con alcohol y luego con pasta Nuprep. Tome la base del electrodo de copa con el índice y cuidadosamente tome una porción de pasta Ten 20. Para fijar el electrodo se recomienda colocar un círculo de tela quirúrgica o sanita, así se fijará mejor el electrodo al cuero cabelludo. Se recomienda que los cables ordenadamente vayan en dirección paralela de lóbulo frontal a parietal.
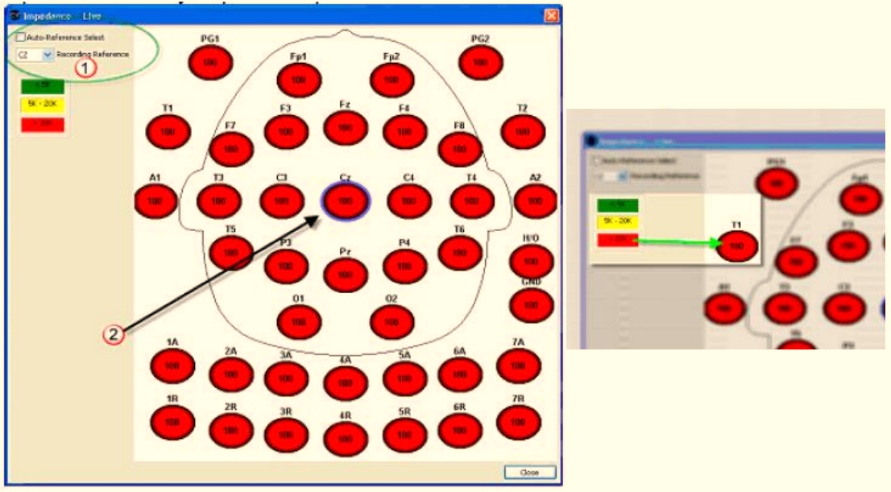
Fig. 3. Comprobación de impedancia desde software Easy III: Haga clic en el botón Impedancia de la barra de herramientas Easy III EEG/LTM. Niveles de impedancia que son buenos se mostrarán con fondo de color verde en la entrada. En el ejemplo siguiente, la impedancia es mayor que 20 K, por lo tanto, el color de fondo es de color rojo.
Actividad 2. Registro de electroencefalograma (desarrollo de la práctica)
1.- Identificación de artefactos que se presentan en el EEG.
- Artefacto de origen muscular: el sujeto presiona con cuidado la mandíbula, aprieta ojos y frunce el ceño durante 10 segundo.
- Artefacto por movimiento de ojos: Se solicita al sujeto que abra y cierre los ojos o que los mueva de manera horizontal.
- Artefacto de mover la lengua: Se solicita al sujeto que mueva la lengua dentro de su cavidad bucal
- Artefacto de movimiento: Mover con cuidado la cabeza de lado izquierdo a derecho.
- Artefacto de electrodo con alta resistencia: Con cuidado se quita un electrodo del cuero cabelludo para lograr que un canal no registre.
- Artefacto de ruido de 60 Hz. Se coloca algún aparato eléctrico cerca del amplificador.
2.- Identificación de ritmos alfa y beta.
El sujeto de estudio permanecerá en posición sentada, en reposo, relajado, con los ojos cerrados y sin moverlos durante los 15 segundos que dura el registro.
El sujeto de estudio permanecerá en posición sentada, en reposo, relajado, con los ojos abiertos sin moverlos y sin parpadear durante los 15 segundos que dura el registro.
El sujeto de estudio nuevamente permanecerá en posición sentada, en reposo, relajado, con los ojos cerrados y sin moverlos durante los 15 segundos que dura el registro.
3.- Identificación de estímulos que pueden modificar los ritmos presentes (maniobras de activación).
Pensamiento abstracto. El sujeto de estudio permanecerá en posición sentada, en reposo, relajado, con los ojos cerrados y sin moverlos durante 20 segundos.
El sujeto de estudio permanecerá en posición sentada, en reposo, relajado, con los ojos cerrados y sin moverlos durante 20 segundos mientras que realiza cálculos mentales.
Efecto de la música. El sujeto en posición sentado con los ojos cerrados y con cuidado se le presenta Música Clásica o Música de Rock durante 20 segundos.
Efecto de la hiperventilación. Sujeto con ojos cerrados sin moverlos, se registran 20 segundos en condiciones basales y después se le pide que hiperventile por 2 minutos, se comparan ambos registros.
Efecto de la fotoestimulación. Colocar la lámpara estroboscópica frente al sujeto y estimular a diferentes Hz durante 10 segundos.
4.- Cambios en la actividad oscilatoria durante el sueño.
Si se solicitó al participante desvelarse se pueden registrar algunas fases de sueño, sin embargo, usualmente se requiere que el trazado contenga por lo menos 20 minutos de registro técnicamente satisfactorio.
- Referencias
- Barrett, K. E. (2013). Ganong fisiología médica (24a. ed.), McGraw Hill Mexico.
- Koeppen, B. M. and B. A. Stanton (2017). Berne and Levy Physiology E-Book, Elsevier Health Sciences.
- Rhoades, R. A. and D. R. Bell (2018). Fisiología Médica: Fundamentos de Medicina Clínica, Lippincott Williams & Wilkins.

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional






Comentarios recientes