
Índice glucémico. Metabolismo y control de la glucemia.
Objetivos de aprendizaje
Describe los procesos involucrados en la regulación de la glucemia y ejemplifica a través de la medición de dicha variable por vía capilar.
Resultado de aprendizaje
El alumno integra los procesos implicados en el metabolismo de la glucosa y su regulación por el sistema endocrino para mantener la glucemia en rangos normales.
Glosario de términos
Glucosa: Monosacárido de la familia de las aldohexosas y principal azúcar del que se derivan la mayoría de los glúcidos.
Glucemia: La glucemia es la concentración o cantidad de glucosa en la sangre.
GLUT: Son una familia de proteínas que ayudan al transporte de la glucosa a través de las membranas a los diferentes tejidos.
SGLT: Son una familia de transportadores de glucosa que se encuentran en la mucosa del intestino delgado (SGLT1) y en las células del túbulo proximal de las nefronas en el riñón (SGLT1 y SGLT2).
Incretina: Las incretinas son hormonas intestinales liberadas al torrente circulatorio en respuesta a la ingestión de nutrientes.
Hormonas contra insulínicas: grupo de hormonas que tienen un efecto contrario a la insulina: se encargan de la degradación del glucógeno solo con fines energéticos musculares
Insulina: Hormona elaborada por las células de los islotes del páncreas. Controla la cantidad de azúcar en la sangre al almacenarla en las células, donde el cuerpo la puede usar como fuente de energía.
Introducción
Mantener niveles adecuados de glucosa en sangre (75-100 mg/dl) es fundamental para mantener una buena homeostasis del organismo. Los niveles bajos de glucosa pueden producir alteraciones cognitivas, pérdida de la conciencia, convulsiones e, incluso, la muerte. Niveles crónicamente elevados de glucosa pueden producir daño en múltiples sistemas, siendo los principales: cardiovascular, renal, nervioso e inmunológico, entre otros.
El consumo de alimentos es necesario para mantener una fuente de glucosa. Tras consumir un alimento, los niveles de glucosa en sangre se elevarán y requerimos sistemas de control para detectar dichos cambios, y realizar los ajustes necesarios para mantener la glucemia dentro de niveles normales. La glucemia postprandial depende de diversos factores incluyendo el tipo de comida, los mecanismos de absorción y variaciones propias de cada individuo. En un intento de predecir el efecto de diferentes alimentos sobre el cambio en la glucemia postprandial, Jenkins y Wolever propusieron usar el índice glucémico (IG), que cuantifica la respuesta glucémica ante un alimento (consumido en una cantidad fija y sin combinar) que contiene la misma cantidad de carbohidratos que un alimento de referencia (50g de glucosa). Este índice refleja que tan rápido se digieren y absorben los carbohidratos. La glucosa tiene el máximo índice glucémico y se le asigna un valor de 100. La curva de cambios en la glucemia producida por otros alimentos es comparada con la producida por 50g de glucosa para obtener su índice glucémico (Figura 1). Existen alimentos con alto, mediano o bajo índice glucémico.
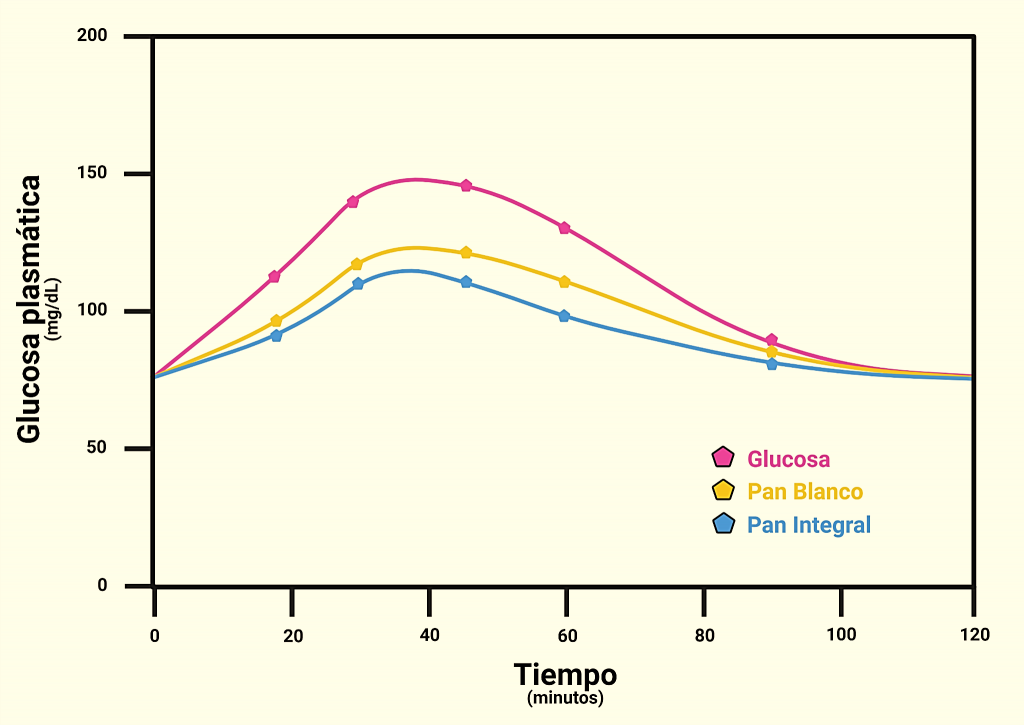
Figura 1. Cambios en la glucemia postprandial tras el consumo de glucosa, pan blanco y pan integral. Utilizando la glucosa como patrón, el área bajo la curva glucémica se establece en un valor arbitrario de 100 unidades. Al comparar las áreas de las curvas asociadas a otros alimentos con esa área, se obtienen los índices glucémicos de dichos alimentos.
Dado que normalmente no se consumen los alimentos en cantidades fijas y sin combinar se propuso usar un parámetro llamado carga glucémica (CG). Para calcular la carga glucémica se considera la siguiente fórmula:
CG = índice glucémico (contenido total de carbohidratos (g) – contenido de fibra (g))/100
Por ejemplo, una ración de un plátano tiene un índice glucémico de 50 aproximadamente y contiene aproximadamente 24 g de carbohidratos, de los cuales 3 g son fibra. Por lo tanto, la carga glucémica de un plátano es: CG = 50 (24-3) / 100 = 10.5.
Conocer el índice glucémico o la carga glucémica de los alimentos puede ser importante en el manejo de enfermedades como la diabetes, donde se prefieren alimentos que no produzcan cambios tan drásticos en los niveles plasmáticos de glucosa. Además, estos valores se relacionan íntimamente con la glucemia y con la insulinemia postprandial.
Además de que la glucemia postprandial difiere de acuerdo con los alimentos que consumimos, existe una gran cantidad de hormonas que mantienen la homeostasis de la glucosa en sangre. Una de estas es la insulina, una proteína sintetizada por las células beta pancreáticas, que se secreta después de consumir una comida rica en hidratos de carbono y permite una rápida captación, almacenamiento y aprovechamiento de la glucosa por casi todos los tejidos, principalmente músculo, tejido adiposo e hígado. Cuando falta insulina, los procesos relacionados con la degradación de los lípidos y su uso con fines energéticos se estimulan. Dentro de las principales hormonas contrarreguladoras de la insulina se encuentran el glucagón (secretado por las células alfa del islote pancreático), el cortisol (secretado por la corteza suprarrenal) y la adrenalina (sintetizada en la médula suprarrenal), las cuales aumentan los niveles de glucosa en sangre y activan la utilización de las reservas energéticas en el organismo, generando disminución en los efectos de la insulina a nivel periférico. La Figura 2 muestra la participación de insulina y glucagón en la regulación de la glucemia.
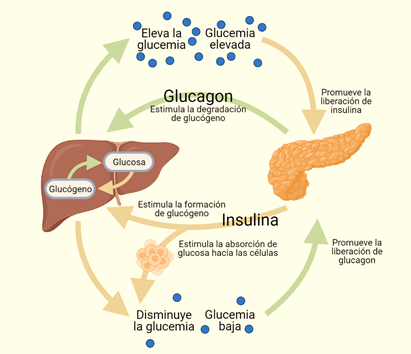
Figura 2. Regulación de la glucemia por las hormonas de los islotes pancreáticos: insulina y glucagón.
2. Actividades en clase
Para las actividades de esta clase se puede medir la glucemia capilar en alumnos voluntarios completamente sanos y darles una carga oral de glucosa y/o desarrollar las actividades que vienen en esta práctica en el apartado 2.2.
2. 1. Glucemia ante sobrecarga oral
2.1.1 Sujetos, materiales y consideraciones especiales
Sujetos
Sepárense en 3 o 4 equipos de acuerdo con el número de personas y seleccionen a un compañero para realizarle la medición de la glucemia.
Materiales y equipos por utilizar:
- Glucómetro
- Tiras reactivas
- Lancetas
- Alcohol
- Torundas
- Jugo o alimento para cada alumno al que se le vaya a realizar el estudio.
Se deben de terne en cuenta algunas consideraciones para realizar las mediciones:
- Ayuno de 4-6 horas
- Alumno sano
2.1.2 Metodología
A) Cada docente realizará con los alumnos una curva de tolerancia a la glucosa, tomando en cuenta la carga de este carbohidrato (considerar de cada bebida o alimento el contenido de fructosa, lactosa, y otros carbohidratos distintos a la glucosa y el contenido de fibra).
B) Se le tomará a cada alumno se le tomará una medición de glucosa basal y cada 30 minutos hasta completar 2 horas.
Llenar con dichos datos la siguiente tabla
| Alumno | Alimento/bebida | Cantidad de glucosa | Basal | 15 min | 30 min | 45 min | 60 min |
C) Graficar los datos
D) Realizar una discusión de los resultados obtenidos y las diferencias entre los sujetos
2.2 Respuesta glucémica ante un alimento
En un estudio para investigar el efecto sobre la glucemia que tenían diferentes alimentos, se seleccionaron voluntarios, se dividieron en 3 grupos a quienes se les pidió ayunar por un periodo de 10 horas y, una vez transcurrido el ayuno, se les dieron diferentes alimentos.
Grupo 1: 250 ml de bebida energética y dos pop-tarts de Kellogs.
Grupo 2: Bagel con 2 cucharadas de crema de cacahuate, y un plátano.
Grupo 3: 200 gramos de jamón y 120 gramos de queso Oaxaca.
A continuación, se dan las características nutricionales de cada tratamiento. Nótese que las calorías totales son muy parecidas.
| Descripción | Kcal | Carbohidratos(g) | Grasa(g) | Proteína(g) | Fibra(g) |
| Bebida energética 250ml | 115 | 26 | 0 | 1 | 0 |
| 2 Pop Tarts de Kellogs | 406 | 76 | 10 | 4 | 1 |
| Total | 521 | 102 | 10 | 5 | 1 |
| Bagel mediano | 280 | 56 | 2 | 11 | 2 |
| Plátano | 105 | 27 | 0 | 1 | 3 |
| 2cucharadas mantequilla de maní | 180 | 6 | 16 | 8 | 2 |
| Total | 565 | 89 | 18 | 20 | 7 |
| 200grjamón | 240 | 8 | 8 | 36 | 0 |
| 120gr queso oaxaca | 280 | 4 | 20 | 36 | 0 |
| Total | 520 | 12 | 28 | 72 | 0 |
En la siguiente página se proporcionan las determinaciones de la glucemia para cada grupo, tanto en ayuno y a diferentes tiempos tras la ingesta de los alimentos.
Registro de glucemia a diferentes tiempos postprandiales
| GRUPO 1 | ||||||||
| S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | |
| Ayuno | 79 | 103 | 107 | 101 | 109 | 72 | 95 | 77 |
| 30 min | 129 | 93 | 92 | 87 | 77 | 152 | 166 | 135 |
| 60 min | 108 | 158 | 141 | 128 | 154 | 175 | 135 | 118 |
| 2 hrs | 105 | 143 | 116 | 105 | 146 | 145 | 109 | 114 |
| GRUPO 2 | ||||||||
| S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | |
| Ayuno | 86 | 79 | 77 | 76 | 77 | 83 | 89 | 71 |
| 30 min | 86 | 159 | 100 | 88 | 124 | 115 | 105 | 87 |
| 60 min | 123 | 147 | 98 | 92 | 103 | 121 | 122 | 100 |
| 2 hrs | 112 | 91 | 89 | 101 | 86 | 115 | 120 | 114 |
| GRUPO 3 | ||||||||
| S1 | S2 | S3 | S4 | S5 | S6 | S7 | S8 | |
| Ayuno | 80 | 79 | 84 | 85 | 92 | 99 | 79 | 78 |
| 30 min | 89 | 84 | 80 | 83 | 102 | 76 | 88 | 87 |
| 60 min | 77 | 89 | 81 | 99 | 95 | 91 | 94 | 83 |
| 2 hrs | 80 | 91 | 82 | 94 | 79 | 86 | 85 | 78 |
Procedimiento:
1. Identifica si existen alteraciones que sugieran un trastorno del metabolismo de los carbohidratos en alguno de los participantes. Se deberán considerar las pendientes de ascenso y descenso de la glucemia.
2. Calcula el promedio y la desviación estándar para cada tiempo dentro de cada grupo. Se recomienda restar la glucemia basal a cada valor de glucemia para expresar la magnitud de cambio en cada caso.
3. Evalúa por medio de una t de Student si hay diferencias significativas entre: a) diferentes puntos de tiempo de un mismo tratamiento, o b) entre diferentes tratamientos al mismo tiempo.
4. Grafica los resultados.
5. Identifica en las gráficas cuál de los grupos recibió alimentos con carga glucémica alta, baja y media.
Resultados
Realiza un reporte de práctica de la actividad realizada. Discute los resultados en el contexto del papel de los sistemas endocrino, gastrointestinal y nervioso en la regulación de la homeostasis de la glucemia.
Referencias
- Guyton, A. C. y Hall, J. E. Tratado de Fisiología Médica. 13a Ed. Barcelona, España. Editorial Elsevier Saunders, 2016.
- Ganong WF. Fisiología Médica. Mc Graw Hill – Lange, 25ª Edición 2016.
- Boron W. y Boulpaep, E. Medical Physiology, 3a Ed., Philadelphia, Editorial Elsevier Saunders, 2017.
- Mari K. Hopper and Luke W. Maurer, Adv Physiol Educ 37: 254–263, 2013 Jenkins DJ, et al. Am J Clin Nutr., 1981.
Esta obra está bajo una
Licencia Creative Commons
Atribución 4.0 Internacional






Comentarios recientes