Fisiología de la motilidad gastrointestinal
Resultado de aprendizaje
Explicar los mecanismos de la motilidad del aparato digestivo a partir de pruebas de imagen.
Integra las funciones motoras del aparato digestivo a partir de casos clínicos.
Objetivos de aprendizaje
Muestra las diferentes fases del vaciamiento gástrico y movimiento peristáltico intestinal a través de imágenes obtenidas con ultrasonido.
Glosario de términos
Colecistocinina: Es una hormona peptídica producida por las células “I” endocrinas en la pared del intestino delgado que tiene diferentes funciones, entre ellas, inhibe la secreción de HCl en estómago, da origen a la sensación de la saciedad en centros reguladores del hipotálamo, actúa como incretina en la célula beta pancreática.
Gastrina: Es una hormona peptídica producida por las células “G” en el antro del estómago que actúa en las células parietales productoras de HCl.
Motilidad: Es la función del sistema digestivo que contracciones del músculo liso que contribuyen al rompimiento físico de los alimentos y al desplazamiento luminal hacia el ano.
Motilina: Es una hormona peptídica liberada por el estómago durante el ayuno cada 1.5-2 horas estimulador por el complejo motor migratorio, actuando en músculo liso de estómago e intestino para promover la motilidad.
Músculo liso: Es un tejido contráctil que no cuenta con un ordenamiento en bandas de sus filamentos de miosina y actina, el músculo liso visceral actúa físicamente sobre el contenido intestinal y moviliza alimentos y fluidos en el tubo digestivo.
Péptido inhibidor gástrico: Es una hormona producida por las células endocrinas “K” en la pared del intestino, que reduce la secreción de ácido gástrico y a su vez reduce la movilidad intestinal.
Péptido intestinal vasoactivo: Es un neurotransmisor liberado por las terminaciones nerviosas entéricas que inhibe la secreción de ácido gástrico.
Peristalsis: Proceso de contracción y relajación que genera movimiento del bolo en sentido anterógrado del aparato gastrointestinal.
Plexo mientérico: Red nerviosa que se encuentra entre las capas musculares del aparato digestivo, que genera los movimientos intrínsecos gastrointestinales.
Plexo submucoso: Red nerviosa localizada desde el esófago hasta el esfínter anal externo. Su función principal es estimular la secreción de hormonas, enzimas y sustancias en el aparato digestivo.
Secretina: Es una hormona peptídica producida por células endocrinas “S” en la pared del intestino, que inhibe la secreción de gastrina e indirectamente la secreción de HCL y estimula la secreción de bicarbonato en el páncreas.
Somatostatina: Es una hormona peptídica producida por diferentes tejidos endocrinos, que inhibe la liberación de la somatotropina en hipófisis, inhibe la liberación de gastrina en el antro gástrico y por tanto la secreción de ácido gástrico, e inhibe la secreción de glucagón principalmente en páncreas.
1. Introducción
1.1 Capas del tracto digestivo
El tracto digestivo tiene en su estructura básica una pared que es muy similar desde el esófago hasta el intestino grueso, aunque cada parte de este aparato tiene algunas características particulares, comparten de manera general la misma constitución de 4 capas (Figura 1):
- Mucosa (en donde se encuentra la luz intestinal)
- Submucosa (debajo de la mucosa)
- Muscular (formada por musculo liso)
- Serosa (formada por tejido conectivo)
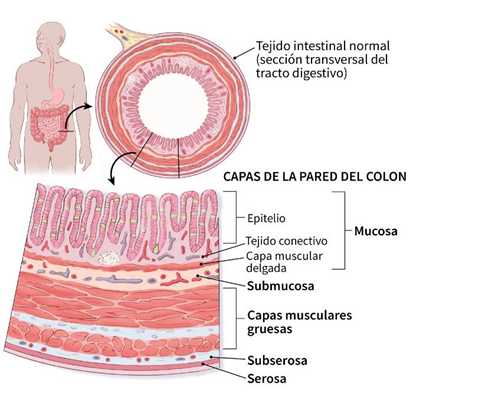
Figura 1. Capas del intestino (obtenido de: https://www.cancer.org/)
La capa mucosa es aquella que determina la sección del aparato digestivo con respecto a las otras, por lo tanto, es la más variable. Esta capa se encuentra constituida a su vez por tres capas más pequeñas: el epitelio mucoso, la lámina propia y la muscular de la mucosa.
La capa submucosa es una capa de tejido conectivo en donde se encuentran los vasos sanguíneos y linfáticos, a su vez contiene al plexo submucoso (también conocido como plexo de Meissner, figura 2) que pertenece al sistema nervioso entérico, el cual inerva a la capa epitelial y al musculo liso de la capa muscular de la mucosa.
La muscular externa consiste en dos capas, una circular interna y una longitudinal externa. Cuando la capa circular se contrae, disminuye el diámetro de la luz, mientras que la contracción de la capa longitudinal acorta el tubo (figura 2). Entre estas dos capas se encuentra el plexo mientérico (también conocido como plexo de Auerbach, figura 2), que controla y coordina la actividad motora de la muscular externa.
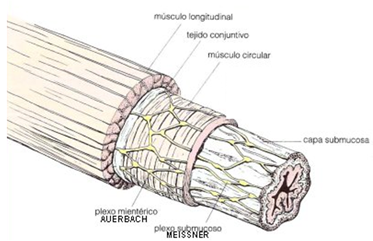
Figura 2. Se muestra la distribución del músculo longitudinal y de la capa de músculo circular, así como la localización del plexo submucoso (Meissner) y mientérico (Auerbach). Modificado de: Medwave Año VII, No. 7, Agosto 2007.
La capa serosa, que es la más externa cubre a todo el tubo digestivo, esta capa está formada por tejido conectivo, siendo éste la continuidad de la membrana peritoneal (peritoneo), la cual reviste la cavidad abdominal. Además, este peritoneo forma láminas de mesenterio, que mantienen a los intestinos en su lugar de manera que no se puedan enredar cuando hay movimiento.
1.2 Motilidad
El tubo digestivo se mueve con dos objetivos: 1) Mover el alimento desde la boca hasta el ano, y 2) Mezclar mecánicamente el alimento para que sea degradado en partículas más pequeñas.
El tubo digestivo tiene dos tipos de contracciones: las tónicas y las fásicas. Las contracciones tónicas se mantienen durante minutos a horas, este tipo de contracciones ocurren en algunos esfínteres y en la porción anterior del estómago. Las contracciones fásicas están caracterizadas por ciclos contracción-relajación que duran algunos segundos, estas son características de la región posterior del estómago y del intestino delgado.
Los ciclos de contracción-relajación están asociados a ciclos de despolarización y repolarización denominados potenciales de onda lenta. Los potenciales de onda lente se producen por una red de células llamadas intersticiales de Cajal (figura 3), las cuales son células de musculo liso modificadas que se encuentran entre las capas de musculo liso y los plexos nerviosos entéricos, además estas células funcionan como un marcapasos para generar potenciales de ondas lentas en diferentes regiones del tubo digestivo.
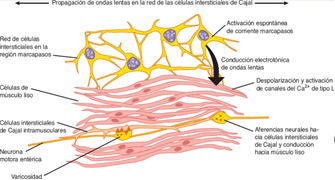
Figura 3. Localización de las células intersticiales de Cajal, su activación genera potenciales de onda lenta (Hammer y McPhee, 7ª edición).
El musculo liso gastrointestinal muestra tres patrones contracción:
- Complejo motor migratorio: Ocurre entre comidas, cuando gran parte del sistema está vacío, comienzan contracciones que van desde el estómago y llegan hasta el intestino grueso, funciona para barrer los restos de alimentos y llevarlos al intestino grueso.
- Peristalsis: Ocurre durante la comida y posterior a esta, la capa muscular circular se contrae detrás del bolo, produciendo ondas que mueven el bolo de una sección del tubo digestivo a otra
- Contracciones segmentarias: Ocurre en pequeñas secciones del intestino, donde la capa muscular se contrae mientras la capa longitudinal se relaja, produciendo que el contenido intestinal se mezcle y tenga mayor contacto con el epitelio para la absorción.
2. Actividades en la sesión.
2.1. Hormonas asociadas al vaciamiento gástrico
El proceso que ocurre en el estómago para mover su contenido desde la luz estomacal hacia las siguientes porciones del intestino se le conoce vaciamiento gástrico. Este vaciamiento está regulado por el contenido de los alimentos, así como ciertos factores hormonales.
Completa el siguiente cuadro con las hormonas que participan en el vaciamiento gástrico y la motilidad intestinal
|
Hormona |
Sitio de producción |
Efecto |
|
Insulina |
|
|
|
Glucagón |
|
|
|
Somatostatina |
|
|
|
GLP-1 |
|
|
|
Péptido intestinal vasoactivo |
|
|
|
CCK |
|
|
|
Polipéptido pancreático |
|
|
|
Motilina |
|
|
|
Péptido YY |
|
|
|
Enterogastrina |
|
|
|
Ghrelina |
|
|
Indicaciones generales
Esta sesión será abordada en 2 etapas, durante la primera y con ayuda de tu profesor realizarás una ecografía abdominal en compañeros en ayuno y con distintos estímulos alimenticios, en la segunda analizarás dos viñetas y responderás preguntas de acuerdo con los conocimientos que has adquirido.
2.2. Ecografía Abdominal
2.2.1. Conocimientos importantes
Cuando se hace una ecografía abdominal se pueden apreciar alguno de los siguientes patrones de reflexión de los ultrasonidos.
- Ausencia de reflexión de las ondas sonoras: Cuando todos los ultrasonidos atraviesan la zona.
- Reflexión de algunos ultrasonidos y transmisión de otros: Las ondas sonoras se reflejan en órganos solidos como los riñones y el hígado.
- Reflexión de todos los sonidos: Cuando hay una estructura solida que impide el paso de las ondas de ultrasonido.
En general no se requiere una preparación específica, sin embargo, se recomienda que tengan un ayuno de 4 a 6 horas para disminuir la cantidad de aire dentro del intestino y tener poco peristaltismo.
Inicialmente se recomienda la evaluación de los órganos abdominales sólidos y posteriormente el estudio del intestino delgado y grueso. Se sugiere iniciar la evaluación por del intestino en el ciego, debido a que se encuentra en la fosa iliaca derecha, se reconoce por tener materia fecal con sombra acústica (como es un contenido sólido, no permite que las ondas pasen detrás de esta) y falta de peristaltismo. Además, desde el ciego es fácil localizar el íleo terminal, por otra parte, también puede encontrarse el apéndice. Posteriormente se pueden valorar las demás estructuras que se encuentran en la cavidad abdominal.
En la evaluación del tubo digestivo debe tenerse en cuenta los siguientes apartados:
- Características de la pared
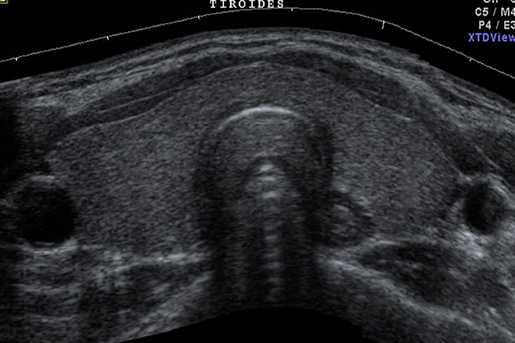
El grosor normal de la pared intestinal es menor de 2mm cuando esta distendida, mientras que si se encuentra colapsada en el intestino delgado es de 3 mm y en el colon es de 4 mm. En algunas zonas como el estómago puede ser más grueso (6 mm), el antro pilórico y el recto llegan a medir hasta 7 mm. Las capas del intestino en la imagen ecográfica se observan en la figura 4.
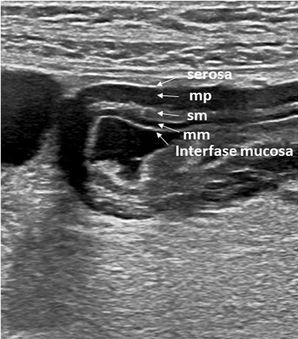
Figura 4. Apariencia ecográfica normal de las capas de la pared del antro gástrico. Imagen axial que muestra 5 capas que, de dentro afuera, son: 1) interfase mucosa, capa ecogénica que representa la interfase de la luz gástrica con la superficie mucosa; 2) muscularis mucosa (mm), capa hipoecoica que representa la capa profunda mucosa; 3) submucosa (sm), capa hipoecoica; 4) muscular propia (mp), capa hipoecoica; 5) serosa, capa ecogénica y la más externa.
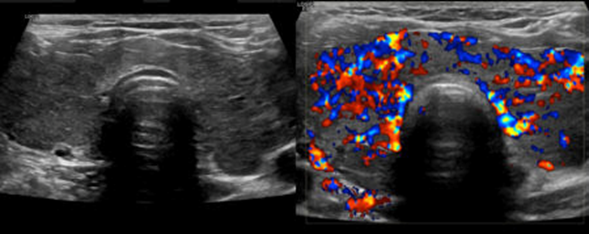
b. Vascularización
Aunque generalmente la pared intestinal tiene poca señal con la ecografía del Doppler color, en algunos procesos inflamatorios se puede ver aumentada, mientras que en la isquemia (ausencia de flujo sanguíneo) puede estar ausente (Figura 5).
Figura 5. Se muestra la vascularización del intestino sin y con Doppler color. a) Ecografía del vacío derecho en un paciente con enfermedad de Crohn, que muestra un asa de intestino delgado dilatada y con contenido intestinal en la luz. Distalmente, se aprecia un engrosamiento homogéneo de la pared (flecha fina), que condiciona una que condiciona una estenosis (flechas gruesas), provoca obstrucción y asocia inflamación de la grasa que rodea la porción mesentérica del asa (asterisco). b) La ecografía Doppler color del mismo segmento demuestra una marcada hiperemia de la pared del asa estenótica y de los vasos mesentéricos.
c. Peristaltismo
Esta es una de las características más interesante para las que se puede utilizar la ecografía abdominal. La estimación y cuantificación de esta, es subjetiva y depende de factores externos como el ayuno y los alimentos que se consuman, así como su regulación nerviosa. En esta se evalúan la frecuencia y la amplitud de los movimientos. Observa el siguiente video:
https://www.youtube.com/shorts/CBiOxvhy1wM
d. Hallazgos extraintestinales
Durante la realización de la ecografía abdominal se pueden encontrar algunas alteraciones en la pared del tubo digestivo como ulceras, fistulas, abscesos, divertículos, masas y tumoraciones. Además, se pueden encontrar algunas otras alteraciones como gas extra luminal (neumoperitoneo)
2.2.2. Material y métodos
Materiales: Equipo de ecografía, gel para USG, participante en ayuno de al menos 6 horas, alimentos con distinta cantidad de carbohidratos, lípidos y proteínas de acuerdo con el número de participantes.
Se sugiere:
|
Nombre del participante |
Ayuno |
Alimento |
|
1 |
6 horas |
Agua o jugo (1 L) |
|
2 |
6 horas |
Alimento rico en carbohidratos (200 gr) |
|
3 |
6 horas |
Alimento rico en proteínas (200 gr) |
|
4 |
6 horas |
Alimento rico en grasas (200 gr) |
Métodos:
PASO 1. Hacer una ecografía del antro gástrico, el tejido hepático, la vesícula biliar y el intestino delgado durante el ayuno como control.
PASO 2. Dar cada alimento al participante correspondiente y esperar 5-10 minutos para volver a evaluar las características ecográficas del antro gástrico, el tejido hepático, la vesícula biliar y el intestino delgado y de la vascularidad de las estructuras. Tomen evidencia fotográfica.
PASO 3. Evaluar cada 15 minutos hasta medir el término del vaciamiento gástrico.
PASO 4. Responde lo siguiente:
- ¿Cómo se observan las estructuras en ayuno?
- ¿Qué cambia con los alimentos? ¿Es diferente dependiendo del alimento?
- ¿Cuánto tardó en vaciarse el estómago?
- ¿Cuánto tiempo estimas que tardará en vaciarse el intestino delgado? ¿y el intestino grueso?
- ¿El vaciamiento del tracto digestivo depende de las características del alimento?
- ¿Qué hormonas están involucradas en el movimiento del tracto digestivo?
- ¿Cambió la vascularidad en el ecoDoppler? ¿Por qué?
2.3. Viñetas
Indicaciones
Para resolver las siguiente viñetas, investiga los términos que no conozcas y pregunta a tu profesor las características clínicas en las cuales tengas dudas.
Caso 1. Ana tiene dolor
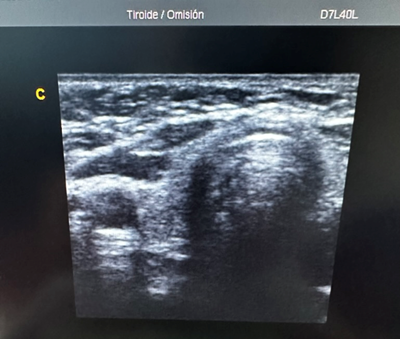
Se presenta Ana, mujer de 9 años al servicio de urgencias por presentar dolor abdominal que inicia en el epigastrio, posteriormente el dolor cambia su ubicación a la fosa iliaca derecha, presenta fiebre de 38.5°C, tiene nausea y tuvo vomito en 3 ocasiones. Se solicita estudios de laboratorio, reportando: Leucocitosis 15000/µl, neutrófilos 85%, Proteína C Reactiva 10 mg/l. Se solicita USG abdominal en donde se encuentra la siguiente imagen que reporta: en fosa iliaca derecha (FID) se identifica asa con fondo ciego en relación con apéndice el cual mide 22 mm, imagen característica en diana con pared de 2.7mm, líquido libre periférico. El paciente es sometido a una apendicetomía laparoscópica para la resolución de la patología.
De manera comparativa se presenta una imagen del apéndice normal (Figura 6).
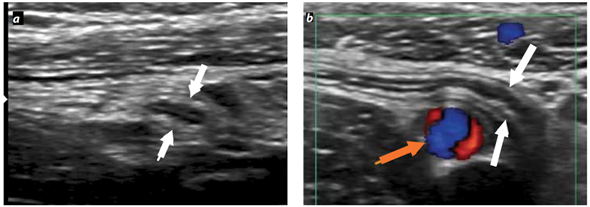
Figura 6. Aspecto ecográfico del apéndice cecal normal (a), comparando con las características del apéndice de Ana (b).
Contesta las siguientes preguntas:
- ¿Qué cambios ocurren en la pared del apéndice que se muestra en b?
- ¿Qué tipo de motilidad debería tener esta persona?
- ¿Cómo debería cambiar la motilidad después de alguna intervención quirúrgica?
- ¿Qué estímulos externos podrían cambiar la motilidad intestinal?
Caso2. ¿Por qué le duele el abdomen a Ángel?
Se presenta Ángel de 42 años al servicio de urgencias, con presencia de dolor abdominal en el hipocondrio derecho que inició después de la ingesta de unos tacos de carnitas, este dolor se irradia al hombro del mismo lado. Se solicita un USG abdominal que reporta hallazgos en relación con litiasis y lodo vesicular y un lito alojado hacia el infundíbulo de la vesícula (posible lito enclavado) con datos sugestivos de moldeamiento del conducto hepático común que no descarta la posibilidad de síndrome de Mirizzi; el grosor mural es de 2.8 mm; además, se asocia con hidrocolecisto.
Se muestran las imágenes de ecografía vesicular de Ángel en la figura 7.
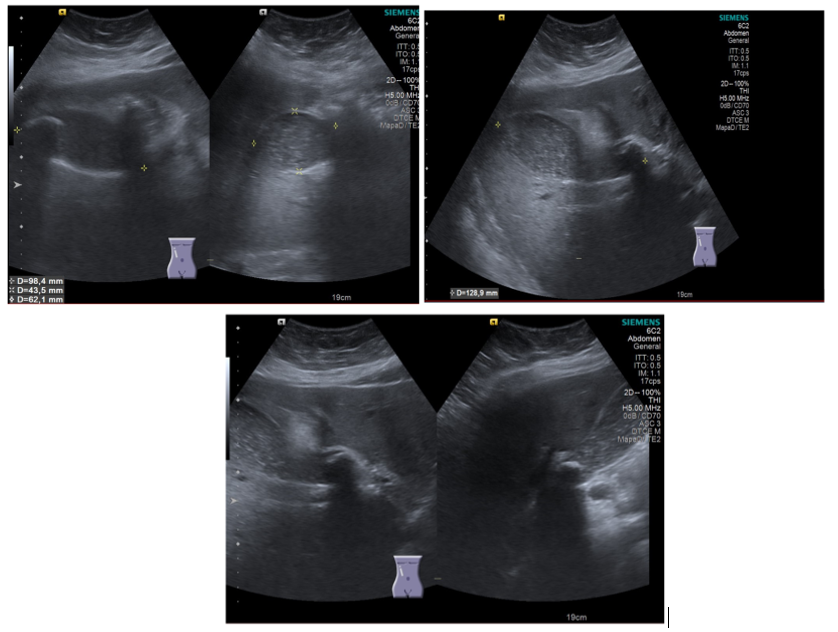
Figura 7. Ecografía realizada a Ángel en la que se observa la vesícula biliar y el lito.
Contesta las siguientes preguntas
- ¿Por qué el dolor empezó después de una comida como “tacos de carnitas”?
- ¿Cómo cambió la pared de la vesícula biliar?
- ¿Cómo se encontrará la motilidad intestinal de este paciente?
- ¿Qué estímulos externos pueden cambiar la secreción de la vesícula biliar?
3. Referencias
- Arévalo O., Moreno M., Ulloa L.
- Guyton & Hall. Tratado De Fisiología Médica. 14 ª Edición. España: Elsevier. 2021.
- Martínez Pérez MJ, et al. Ecografía intestinal: técnicas de examen, patrones normales y patológicos. Radiología. 2020. https://doi.org/10.1016/j.rx.2020.09.004
- Rhoades y Bell, Rodney A., David R. (2018). Fisiología Médica: Fundamentos de medicina clínica (5a. de)
- Fisiología Humana. Un enfoque integrado. 8va Edición. Médica Panamericana. 2019.
- Smith W. L., Farrel T. A. Introducción al diagnóstico por imagen. 4ª Ed. España: Wolters Kluwer; 2014.
Esta obra está bajo una
Licencia Creative Commons
Atribución 4.0 Internacional









Comentarios recientes