Mecanismos de concentración y dilución urinaria. Regulación de la osmolaridad.
Objetivo de Aprendizaje
Describe y ejemplifica los mecanismos de regulación de la osmolaridad mediados por la nefrona.
Resultados de Aprendizaje
Integra los saberes de la formación de orina concentrada y diluida en la resolución de un problema clínico.
Glosario de términos
Excreción: Es el producto final de eliminación resultado de los procesos de filtración, reabsorción y secreción.
Filtración: Paso de sustancias de la sangre hacia el espacio urinario a través de la barrera de filtración glomerular.
Hormona antidiurética (ADH): Es la hormona que interactúa con la nefrona para disminuir la formación de orina. También es conocida como arginina vasopresina (AVP), o argipresina, ya que tiene un efecto vasoconstrictor.
Nefrona: Unidad anatómica y funcional que conforma al riñón.
Nicturia: Micción nocturna frecuente.
Pujo miccional: Sensación de insatisfacción al vaciar la vejiga.
Reabsorción: Paso de sustancias de los túbulos renales hacia los vasos capilares que los rodean.
Secreción: Paso de sustancias de los vasos capilares (capilares peritubulares) que rodean los túbulos hacia los túbulos renales.
Tenesmo vesical: Sensación persistente de ganas de orinar tras haber finalizado la micción.
- Introducción
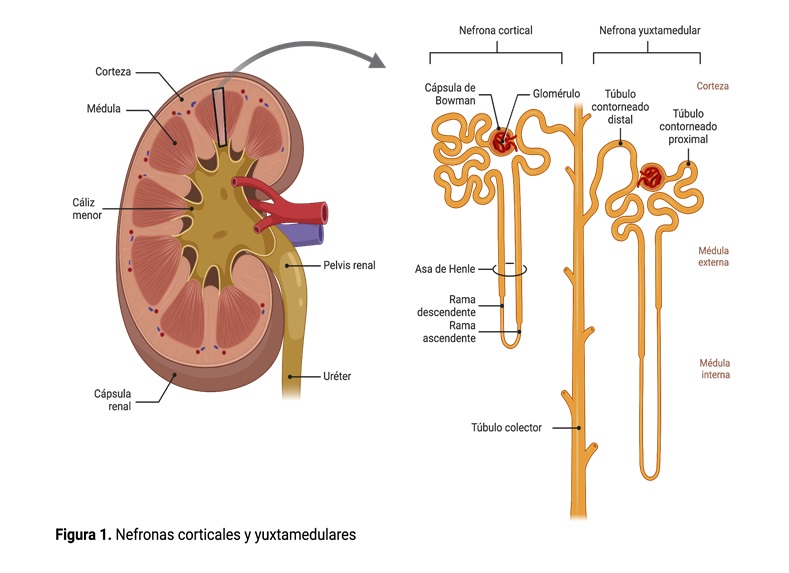
La nefrona es la unidad funcional del riñón y tiene la función de filtrar, reabsorber y secretar sustancias, teniendo como producto final la orina. Existen dos tipos de nefronas: las corticales y las yuxtamedulares (figura 1). Las nefronas corticales son más abundantes y tienen túbulos que apenas penetran en la médula, mientras que las nefronas yuxtamedulares sí tienen túbulos que penetran hasta la profundidad de la médula.

Para entender la fisiología e histología renal es requerido entender los siguientes conceptos:
- Filtración: Paso de sustancias de la sangre hacia el espacio urinario a través de la barrera de filtración glomerular.
- Reabsorción: Paso de sustancias de los túbulos renales hacia los vasos capilares que los rodean.
- Secreción: Paso de sustancias de los vasos capilares (capilares peritubulares) que rodean los túbulos hacia los túbulos renales.
- Excreción: Es el producto final de eliminación resultado de los procesos de filtración, reabsorción y secreción.
La filtración o ultrafiltrado de la sangre se lleva a cabo en la barrera de filtración glomerular, la cual está formada por diferentes componentes situados en el corpúsculo renal:
- Endotelio capilar glomerular: son capilares que presentan fenestraciones de un diámetro mayor de 70-90 mm, más abundantes y de contornos más irregulares que las fenestraciones de otros capilares. El diafragma en estos capilares está ausente.
- Membrana basal glomerular: llamada lámina basal gruesa, es una membrana basal que se forma a partir de la fusión de la membrana basal de los podocitos y la membrana basal de las células endoteliales glomerulares. Presenta un alto contenido de colágena tipo IV.
- Capa visceral de la cápsula de Bowman: contiene las células epiteliales viscerales o podocitos. Estas células emiten prolongaciones alrededor de los capilares glomérulares; las primeras prolongaciones se llaman prolongaciones primarias y de ellas salen prolongaciones secundarias, también conocidas como pedicelos. Los espacios entre las prolongaciones se denominan ranuras o hendiduras de filtración, con aproximadamente 25 mm de ancho, y permiten el ultrafiltrado de la sangre.
El verdadero filtro está en las láminas raras debido a su alto contenido en glucosaminoglicanos polianiónicos, que restringen el movimiento de partículas y moléculas con carga negativa) a través de la membrana basal glomerular. Por esta razón, de manera normal, el riñón no permite el paso de proteínas en la orina, por lo que su presencia en esta se traduce en una alteración de la composición de la membrana basal glomerular.
Filtración glomerular
El primer paso para la formación de orina es la filtración glomerular. De aproximadamente 180 l de líquido filtrado al día, la mayor parte se absorbe, dejando únicamente 1 l para su excreción; esta alta tasa de filtración glomerular depende de la alta tasa de flujo sanguíneo renal y las propiedades especiales de las membranas de los capilares glomerulares.
Composición del filtrado glomerular y sus diferencias con el plasma
Como la mayoría de los capilares, los capilares glomerulares son relativamente impermeables a proteínas, por lo que el líquido filtrado, llamado filtrado glomerular, carece prácticamente de estas, así como de elementos celulares, incluidos los eritrocitos.
Las concentraciones de otros constituyentes del filtrado glomerular, como la mayoría de las sales y moléculas orgánicas son similares a las concentraciones en el plasma; sin embargo, algunas sustancias con peso molecular bajo, como el calcio y los ácidos grasos, que no se filtran libremente porque están unidas parcialmente a las proteínas plasmáticas tienen, en el filtrado glomerular, concentraciones diferentes a las observadas en el plasma.
La filtración glomerular está determinada por: 1) el equilibrio entre las fuerzas hidrostáticas y coloidosmóticas que actúa a través de la membrana capilar (figura 2), y 2) el coeficiente de filtración capilar (), el producto de la permeabilidad por el área de superficie del filtro de los capilares. Los capilares glomerulares tienen una presión hidrostática glomerular alta (60 mmHg) y una gran filtración capilar. En el adulto promedio la filtración glomerular es de 125 ml/min o 180 l/día. La fracción del flujo plasmático renal que se filtra (la fracción de filtración) es de aproximadamente 0.2, lo que significa que alrededor del 20% del plasma que fluye a través del riñón se filtra a través de los capilares glomerulares. El riego sanguíneo de los dos riñones es normalmente alrededor del 22% del gasto cardiaco lo que equivale aproximadamente a 1,100 ml/min.
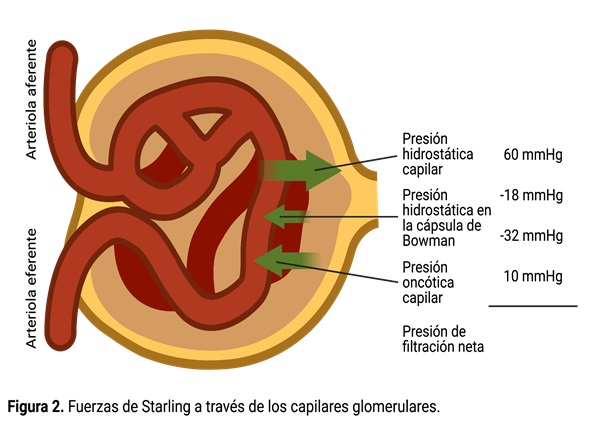
La FG está determinada por: 1) la suma de las fuerzas hidrostática y coloidosmótica a través de la membrana glomerular, que da lugar a la presión neta de filtración, y 2) el coeficiente de filtración.
Coeficiente de filtración
El coeficiente de filtración ) es una medida del producto de la conductividad hidráulica y el área superficial de los capilares glomerulares; no puede medirse directamente, pero se calcula experimentalmente con la siguiente fórmula:
filtración glomerular (FG) / presión de filtración neta
Dado que la FG total en los dos riñones es de unos 125 ml/min y la presión de filtración neta 10 mmHg, el normal se calcula en unos 12.5 ml/min/mmHg de presión de filtración. Cuando el se expresa por 100 g de peso renal, tiene un promedio de alrededor 4.2 ml/min/mmHg, un valor unas 400 veces mayor que el de la mayoría de los otros sistemas capilares del cuerpo. Este alto de los capilares glomerulares contribuye a la filtración rápida de líquido.
Aunque el aumento del eleva la FG y la reducción del , la reduce, los cambios en probablemente no constituyen un mecanismo importante de la regulación normal de la FG. Pero algunas enfermedades reducen el al reducir el número de capilares glomerulares funcionales (reduciendo así el área superficial para la filtración) o aumentando el espesor de la membrana capilar glomerular y reduciendo su conductividad hidráulica. Por ejemplo, la hipertensión mal controlada y la diabetes mellitus reducen gradualmente el al aumentar el espesor de la membrana basal capilar glomerular, dañando los capilares de forma tan grave que se pierde la función capilar.
Mecanismos de concentración y dilución urinaria
Los riñones ajustan su diuresis para compensar las ingestas de agua anormalmente bajas o altas, o las pérdidas anormalmente altas por otras rutas. Las hormonas involucradas en la coordinación de estas funciones incluyen la angiotensina II, aldosterona, el péptido natriurético auricular (PNA) y la hormona antidiurética (ADH), también llamada vasopresina. Los riñones necesitan excretar unos 600 miliosmoles/día, independientemente del volumen de agua excretada, lo cual puede calcularse mediante la siguiente fórmula:
Osmoles excretados/día = UOsm ⋅ V
donde UOsm es la osmolaridad de la orina y V es la diuresis al día.
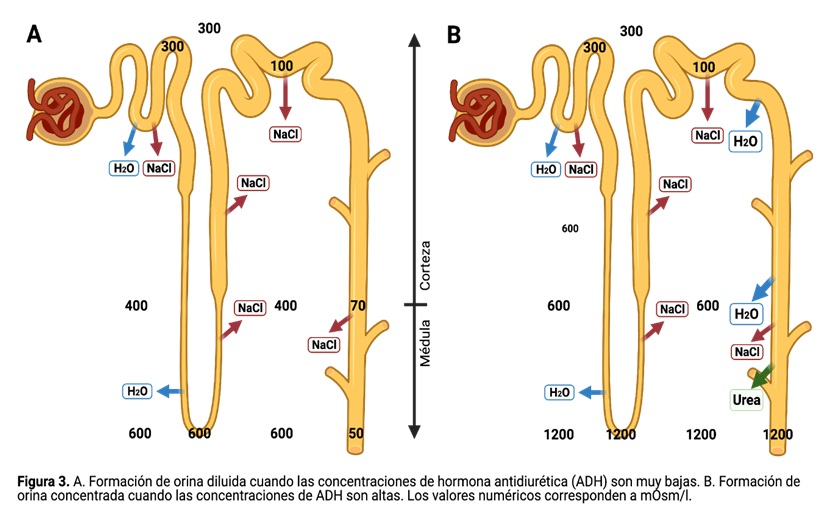
Cuando la ingesta de agua es especialmente alta, el riñón humano puede generar orina con una osmolalidad tan baja como 40 miliosmoles (mOsm), diluyendo la orina unas 7.5 veces con respecto al plasma. Como los riñones deben seguir secretando 600 mOsm de solutos, el volumen de orina en una diuresis acuosa extrema se elevaría hasta los 15 l/día.
Por otra parte, cuando es preciso conservar agua (p. ej., cuando está restringida la ingesta de agua o cuando las pérdidas son excesivas), el riñón es capaz de generar orina con una osmolaridad alta de hasta 1 200 mOsm, concentrando la orina alrededor de 4 veces con respecto al plasma sanguíneo. Como los riñones deben seguir secretando 600 mOsm de solutos, el volumen de orina en una diuresis acuosa extrema se disminuye hasta los 0.5 l/día.
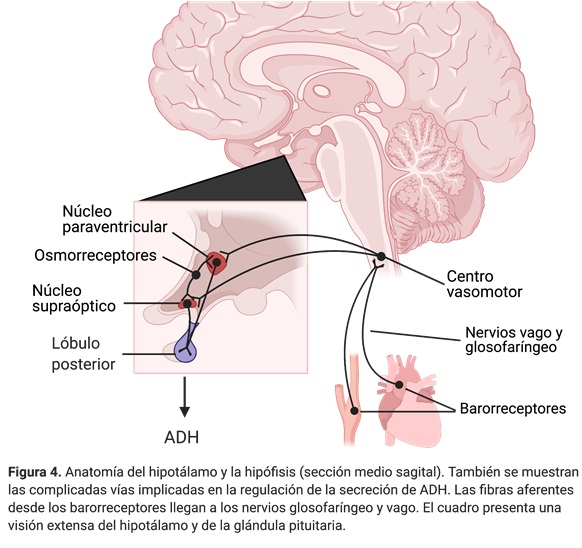
Cuando la osmolaridad de los líquidos corporales aumenta por encima de lo normal, el lóbulo posterior de la hipófisis secreta más ADH, que aumenta la permeabilidad al agua de los túbulos distales y de los conductos colectores, aumentando la reabsorción de agua. En cambio, una disminución de la osmolaridad del líquido extracelular disminuye la secreción de ADH, lo que disminuye la permeabilidad al agua y conduce a la excreción de mayores cantidades de orina diluida. De este modo, la presencia o falta de ADH determina, en gran parte, que el riñón excrete una orina diluida o concentrada (figura 3).
La figura 4 muestra los componentes básicos del sistema de retroalimentación osmorreceptor-ADH para el control de la concentración de sodio y la osmolaridad del líquido extracelular. Asimismo, puede observarse que la liberación de ADH está controlada también por reflejos cardiovasculares que responden a reducciones de la presión arterial y el volumen sanguíneo, originados en barorreceptores arteriales (en el cayado aórtico y el seno carotídeo) y receptores de baja presión (en las aurículas y las arterias pulmonares), respectivamente.
- Actividad en la sesión: aprendizaje basado en casos
- Viñeta clínica #1
Se presenta a su consultorio un paciente masculino de 50 años con molestias al orinar. Refiere haber iniciado hace un mes de manera progresiva con pujo miccional y dificultad para iniciar la micción, así como episodios de nicturia. Actualmente presenta tenesmo vesical (deseo de orinar), disminución de la fuerza del chorro, así como su calibre. A la exploración física presenta globo vesical en hipogastrio, tenso a la palpación. Se realiza tacto rectal evidenciando la próstata con aumento de tamaño, simétrica al tacto. Se realiza ultrasonido vesical y renal donde se evidencia un aumento en el volumen urinario residual, así como hidronefrosis (dilatación del sistema colector renal). Se integra un diagnóstico de retención aguda de orina secundario a hiperplasia prostática benigna.
Responda lo siguiente y justifique su respuesta.
1. ¿Qué cambios esperarías en la filtración glomerular (FG)?
a. Aumento de la FG
b.Disminución de la FG
c. No presenta cambios por los mecanismos de compensación
2. Mediante un esquema muestre los cambios en la presión de filtración neta. ¿Qué relación tiene con la FG?
3. ¿Cuál sería la respuesta esperada por parte de la mácula densa?
a. Aumentar la resistencia aferente
b. Aumentar la resistencia eferente
c. Aumentar el área superficial en los capilares glomerulares
4. La respuesta simpática en el sujeto, ¿qué efecto tendría en la FG?
a. Aumentar la resistencia aferente
b. Aumentar la resistencia eferente
c. Aumenta el área superficial en los capilares glomerulares
- Viñeta clínica #2
María, de 19 años, pertenece al equipo femenil de atletismo de su escuela. Durante su entrenamiento, tras haber recorrido 10 km, presenta visión borrosa y cae inconsciente al piso.
1. ¿Qué células son las principales liberadoras de renina en el cuerpo humano?
a. Mácula densa
b. Células yuxtaglomerulares de la arteriola aferente
c. Células yuxtaglomerulares arteriola eferente
2. ¿Cuál es el sitio principal de acción de la aldosterona?
a. Túbulo colector
b. Túbulo proximal
c. Asa de Henle porción fina
d. Asa de Henle porción gruesa
3. María presenta resistencia a la aldosterona endógena, ¿cómo esperaría encontrar los electrolitos séricos?
a. Potasio <3.5 mEq/l, Sodio <135 mEq/l
b. Potasio >4.5 mEq/l, Sodio >145 mEq/l
c. Potasio >4.5 mEq/l, Sodio <135 mEq/l
d. Potasio <3.5 mEq/l, Sodio >145 mEq/l
Viñeta clínica #3
Julián, biólogo marino, se encuentra estudiando la vida de la tortuga golfina, durante su expedición su bote es embestido por una ballena y pierde su reserva de agua, por lo que debe beber agua de mar.
¿Qué osmolaridad plasmática presentaría Julian?
a. <280 mosm/l
b. >295 mosm/l
2. ¿Dónde se sintetiza principalmente la vasopresina?
a. Núcleo paraventricular
b. Tracto solitario
c. Núcleo supraóptico
3. Describa mediante un esquema las vías que actúan durante un estímulo de sed.
4. Explique la respuesta renal ante una hidratación hipertónica (agua de mar).
5. Basado en tus conclusiones previas, ¿qué cambios esperarías encontrar en el volumen y la osmolaridad de los compartimientos líquidos de Julián? Contesta en relación a la figura 5 y justifica tu respuesta.
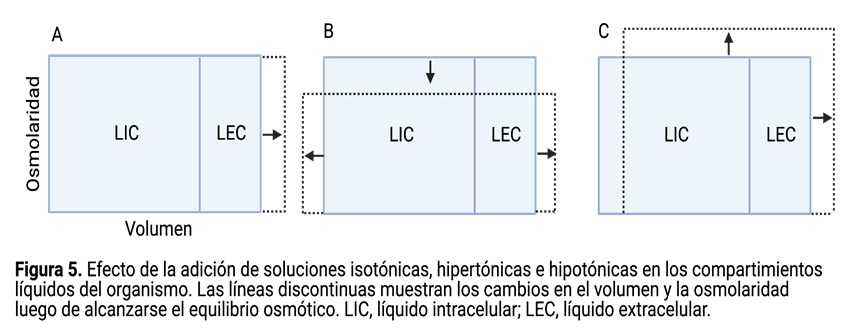
6. Si Julián hubiese tomado grandes cantidades de agua simple en vez de agua de mar, ¿qué cambios esperarías encontrar? Contesta en relación a la figura 5 y justifica tu respuesta.
- Viñeta clínica #4
Femenino de 80 años con diagnóstico de síndrome depresivo mayor de 6 meses de evolución. Es traída a urgencias por sus familiares al presentar náuseas y alucinaciones. A la exploración física se encuentra desorientada en tiempo y lugar. Se realiza química sanguínea y electrolitos séricos con los siguientes valores: Na+ 120 mmol/l, K+ 3.9 mmol/l, Cl- 90 mmol/l, Glucosa 88 mg/dl, BUN (nitrógeno ureico en sangre) 20 mg/dl, Na+ urinario 20 mmol/l y osmolaridad urinaria 370 mg/dl.
- Calcule la osmolaridad plasmática.
- Observa los escenarios que plantea la figura 5 y contesta: ¿cuál sería el efecto de administrar una solución isotónica?
- Explique el mecanismo de control entre la hormona antidiurética y la osmolaridad urinaria.
- ¿Cuál sería el efecto de la suplementación de urea en la paciente?
- ¿Qué porción(es) del sistema colector muestra mayor actividad ante el aumento de ADH? Explica el mecanismo.
- Ante un paciente con resistencia a ADH ¿cómo esperarías encontrar la osmolaridad urinaria?
Referencias:
- Hall, J. E. (2016). Guyton y Hall. Tratado de fisiología médica. 13ª edición. España: Elsevier.
- Barret, K. E, Barman, S. M., Boitano, S., y Brooks, H. L. (2016). Fisiología Médica. 25ª edición. México: Mcgraw-Hill.
- Koeppen, B. M., y Stanton, B. A. (2018). Berne & Levy. Fisiología. 7ª edición. España: Elsevier.
Esta obra está bajo una
Licencia Creative Commons
Atribución 4.0 Internacional



Comentarios recientes