Práctica de pH. Medición del pH de orina y saliva en distintas condiciones fisiológicas.
Objetivo de aprendizaje
- Describe las variaciones de los valores de pH en la orina y la saliva bajo diferentes condiciones fisiológicas: estado basal, hiperventilación y ejercicio físico moderado.
Resultado de aprendizaje
- Analiza los mecanismos que modifican el pH en el organismo y sus respuestas compensatorias.
Glosario de términos
Ácido: Sustancia química capaz de ceder protones (H+) a otra sustancia química.
Amortiguador: Son sustancias que resisten los cambios del pH y responden de inmediato a los desequilibrios del estado ácido base.
Anión: Ion con carga eléctrica negativa, es decir, que ha ganado más electrones.
Base: Sustancia química capaz de captar protones (H+) de otra sustancia química.
Catión: Ion con carga eléctrica positiva, es decir, que ha perdido electrones.
Ecuación de Henderson-Hasselbach: Se utiliza para calcular el pH de una solución buffer o tampón, a partir del pKa (la constante de disociación del ácido) y de las concentraciones de equilibrio del ácido o base, del ácido o la base conjugada.
Ion: Átomo o molécula que tiene una carga eléctrica positiva o negativa.
pH: una medida que indica la acidez o la alcalinidad del agua. Se define como la concentración de iones de hidrógeno en el agua. La escala del pH es logarítmica con valores de 0 a 14.
Protón: Son las partículas con carga positiva que se encuentran dentro del núcleo de un átomo, para el caso de este tema, protones serán H+.
- Introducción
El mantenimiento del pH del medio interno, dentro de unos límites estrechos, es de vital importancia para los seres vivos. Es una de las constantes que el organismo trata de mantener con más tenacidad, por ser fundamental en la actividad enzimática y otras funciones vitales.
Diariamente el metabolismo intermedio va a generar una gran cantidad de ácidos, pese a lo cual, la concentración de hidrogeniones [H+] libres en los distintos compartimentos corporales va a permanecer fija dentro de unos límites estrechos.
Ello es debido a la acción de los amortiguadores fisiológicos que van a actuar de forma inmediata impidiendo grandes cambios en la concentración de hidrogeniones, y a los mecanismos de regulación pulmonar y renal, que son en última instancia los responsables del mantenimiento del pH.
1.1 Protón
Núcleo electropositivo del átomo de hidrógeno ordinario. Partícula elemental y estable. Cuando se disuelve el hidrógeno en agua se ioniza en H+ y un electrón. Los núcleos de todos los elementos contienen un número de protones señalado por el número atómico del elemento.
1.2 Ácido y base
Siguiendo la definición de Bronsted, un ácido es aquella sustancia capaz de ceder iones H+ y una base es aquella capaz de captar iones H+. Existen dos clases de ácidos importantes en fisiología: Ácido carbónico (H2CO3) y Ácidos no Carbónicos. Hacer esta distinción es importante debido a las diferentes tasas de producción y rutas de eliminación de estos ácidos. Los ácidos y bases se pueden clasificar en fuertes y débiles. Son ácidos y bases fuertes aquellos para los que, en concentraciones ordinarias, prácticamente todas sus moléculas están disociadas. Los ácidos y bases débiles tienen constantes de ionización pequeñas, de forma que cuando se disuelven con concentraciones ordinarias de agua gran parte de sus moléculas se mantienen sin disociar.
1.3 Acidez de una solución
Depende de su concentración en H+ con independencia de la sustancia disociada que lo libera
1.4 Constante de disociación
La constante de disociación ácida K se puede definir como una relación entre las concentraciones de ácido disociado y sin disociar.
Kc= ([A] • [B]) / [AB]
En los ácidos fuertes K adquiere mayor valor, dado que las concentraciones de A y B serán altas y la concentración AB (ácido sin disociar) será baja. Si el valor de K para un ácido es bajo, esto significa que es un ácido débil, se disocia escasamente, por lo tanto, las concentraciones de A y B serán bajas, y la concentración de AB será elevada.
Por lo tanto, podemos decir que la constante de disociación ácida K, es una medida cuantitativa de la fuerza de un ácido.
Una sustancia disociable en solución libera electrolitos, alcanza siempre un nivel en el que se estabiliza una fracción disociada y otra sin disociar. En ese momento la velocidad de disociación y la de reconstrucción son idénticas.
1.5 Ley de acción de masas
La ley de acción de masas postula que la velocidad de una reacción es proporcional al producto de las concentraciones de sus reactantes. Conforme se va agotando la sustancia disminuye la velocidad de disociación hasta igualar a la reconstrucción.
Por ejemplo: el agua puede disociarse en hidrógeno e hidroxilo:
H2O H+ + OH–
1.6 pH
Logaritmo inverso de la concentración de hidrogeniones, expresa la cantidad de H+ de una solución. Expresar cifras tan bajas de concentración (nanogramos) es incómodo por lo que la obtención de su logaritmo negativo proporciona cifras de más fácil comprensión y por tanto más fácil manejo. Tabla 1
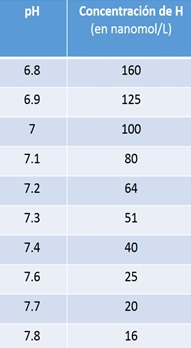
Tabla 1. Relación entre el pH arterial y la concentración de H+
1.7 Anión Gap
Para mantener la electroneutralidad, las cargas positivas (cationes) deben igualar a las cargas negativas (aniones); si no ocurre así, aparece un anión gap cuyo valor normal es de 8 a 16 mEq/l y que se calcula con la siguiente ecuación:
Anión Gap = Na+ – (Cl– + HCO3–)
Tendemos a la acidosis: el metabolismo diario genera 13000-15000 mmol/d de CO2 que podría generar 13.000 mEq de H+ cada día y otros ácidos aportados, por ejemplo, por la dieta (aporta ácidos orgánicos, aminoácidos azufrados, residuos fosfato y sulfato) que aportan unos 70 mEq de H+ también cada día. En condiciones normales la concentración de H+ del líquido extracelular es baja (de unos 40 nEq/l). A pesar de ello, pequeñas fluctuaciones de esta van a tener repercusiones importantes sobre determinados procesos vitales. Por ello, existen unos límites relativamente estrechos entre los cuales la concentración de H+ es compatible con la vida. Dichos valores oscilan entre 16 y 160 nEq/l, lo que equivale a un valor de pH de 7.80 a 6.80 (Tabla 1).
El principal producto ácido del metabolismo celular es el dióxido de carbono (CO2) que viene a representar un 98% de la carga ácida total. Aunque no se trate de un ácido, pues el CO2 no contiene H+, se trata de un ácido potencial ya que su hidratación mediante una reacción reversible catalizada por la anhidrasa carbónica (A.C.) va a generar ácido carbónico.
CO2 + H2O ↔ H2CO3 ↔ H+ + HCO3 –
Al ser un gas, el CO2 va a ser eliminado prácticamente en su totalidad por los pulmones sin que se produzca una retención neta de ácido, por lo que se denomina ácido volátil. Por otra parte, el metabolismo va a generar una serie de ácidos no volátiles, también denominados ácidos fijos que representan de un 1-2% de la carga ácida y cuya principal fuente es el catabolismo oxidativo de los aminoácidos sulfurados de las proteínas. Estos ácidos fijos no pueden ser eliminados por el pulmón siendo el riñón el principal órgano responsable en la eliminación de estos.
1.8 Alteración del pH
Las desviaciones de la normalidad del pH pueden ser hacia la acidosis o hacia la alcalosis. Tanto una como otra pueden depender de variaciones del bicarbonato o de la presión parcial de CO2. En el primer caso el trastorno se califica metabólico y en el segundo respiratorio. Por otra parte, la anormalidad puede estar compensada o descompensada, lo primero cuando los sistemas controladores del pH no afectados por la causa del trastorno consiguen que se mantenga el pH dentro de límites normales y lo segundo cuando no lo logran por haber sido desbordados. (Tabla 2)
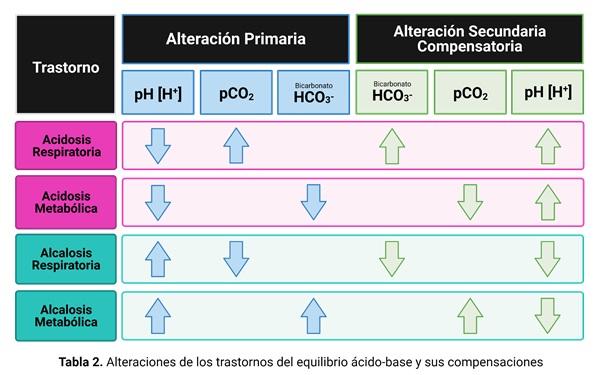
Las consecuencias de la alteración del equilibrio ácido-base son la alteración de la distribución de los iones en los espacios intra y extracelular, lo que modifica la actividad de numerosas enzimas, se producen cambios estructurales en las macromoléculas y alteraciones en equilibrios químicos. Si los trastornos son graves comprometen la vida.
Es tan importante el mantenimiento del pH que hay varios sistemas de compensación que funcionan de forma alternativa, de forma que la disfunción de alguno de ellos debe ser compensada por otro; unos son de actuación inmediata y otros lenta pero definitiva.
Existen unos sistemas de compensación inmediatos que se denomina amortiguación y que se produce en segundos; posteriormente entra en funcionamiento el sistema de compensación pulmonar cuya acción se produce en horas y finalmente se produce la compensación renal que puede tardar varios días en corregir la sobrecarga.
1.9 Amortiguadores
También denominados sistemas tampón o “buffer” (almohadilla o muelle). Representan la primera línea de defensa ante los cambios desfavorables de pH gracias a la capacidad que tienen para captar o liberar protones de modo inmediato en respuesta a las variaciones de pH que se produzcan. (Figura 1).
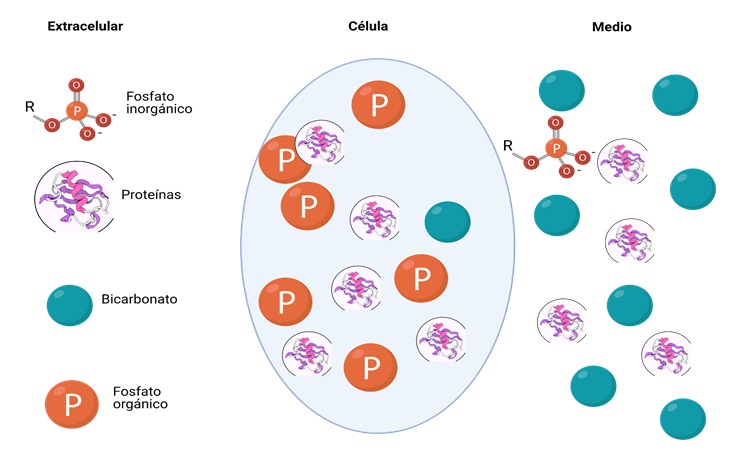
Fig. 1. Distribución de los sistemas “Buffer”
Un sistema tampón es una solución de un ácido débil y su base conjugada:
H (ácido) ↔ H+ + A– (base)
El valor de pH en el cual el ácido se encuentra disociado en un 50% se conoce como pK. El pK representa el valor de pH en el que un sistema tampón puede alcanzar su máxima capacidad amortiguadora. Por tanto, cada sistema buffer tendrá un valor de pK característico. Cuando ingresan radicales ácidos en el medio interno se combinan con el catión de la sal y la consecuencia es la disminución de ésta y el aumento del ácido, pero como éste último es débil, (lo que significa que está poco disociado) el resultado final es que un ácido fuerte que aportaría muchos hidrogeniones se transforma en uno débil y apenas varía el pH.
1.9.1. Amortiguadores proteicos
Las proteínas intracelulares con sus grupos ionizables con diferentes valores de pK contribuyen de forma importante en el mantenimiento del pH, mediante el intercambio de H+ con iones unidos a proteínas que se desplazan al medio extracelular para mantener la neutralidad eléctrica.
Especial mención merece el sistema amortiguador hemoglobina, es un tampón fisiológico muy eficiente debido tanto al cambio de pK que experimenta al pasar de la forma oxidada a la reducida, como a la gran abundancia de esta proteína en la sangre (15% del volumen total sanguíneo) y al hecho de que actúa dentro de los hematíes:
HbH+ ↔ Hb– + H+
Las propiedades amortiguadoras de la hemoglobina desempeñan un papel fundamental en el transporte sanguíneo del CO2 tisular hasta su eliminación pulmonar. En el interior del hematíe, por acción de la Anhidrasa Carbónica, el CO2 se va a convertir en ácido carbónico que se disocia dando un H+ que rápidamente será tamponado por la hemoglobina, y bicarbonato que saldrá del hematíe en intercambio con iones cloro.
1.9.2. Amortiguador fosfato
Ejerce su acción fundamentalmente a nivel intracelular, ya que es aquí donde existe una mayor concentración de fosfatos y el pH es más próximo a su pK (6.8). Interviene junto a las proteínas celulares de manera importante en la amortiguación de los ácidos fijos:
PO4 H2 ↔PO4 H– + H+
1.9.2. Amortiguación ósea
El hueso interviene en la amortiguación de la carga ácida captando los H+ en exceso o liberando carbonato a la sangre por disolución del hueso mineral. El papel más importante del hueso en la amortiguación ocurre en situaciones de acidosis crónica tales como en los casos de insuficiencia renal crónica en la que la parathormona juega un papel fundamental. Este sistema de amortiguación también va a intervenir en presencia de una carga básica a través del depósito de carbonato en el hueso.
1.9.3. Amortiguador carbónico/bicarbonato
Poco potente desde el punto de vista químico, (pK =6.1). Es el tampón más importante en la homeostasis del pH porque:
- Está presente en todos los medios tanto intracelulares como extracelulares. En el medio extracelular la concentración de bicarbonato es elevada (24 mEq).
- Es un sistema abierto: la concentración de cada uno de los dos elementos que lo componen son regulables: el CO2 a nivel pulmonar y el bicarbonato a nivel renal.
- La suma de las concentraciones del ácido y de la base no es constante, lo cual aumenta muchísimo su capacidad amortiguadora. La relación existente entre el ácido y la base nos viene dada por la ecuación de Henderson-Hasselbalch:
pH = pK + Log [HCO3–] / [H2 CO3]
o
pH = pK+ Log [ HCO3–] / [ PaCO2]
Cualquier cambio de pH se va a traducir como una alteración de la relación carbónico/bicarbonato, puesto que el pH prácticamente solo va a depender de dicha relación y no de los valores absolutos de las concentraciones de ambos. Por tanto, si la relación carbónico/bicarbonato se eleva por encima de 20/1 estaremos ante una situación de alcalosis y si la relación es inferior a dicho valor se tratará de una acidosis. Es importante tener en cuenta que todos los sistemas “buffer” están interrelacionados y que se amortiguan unos a otros, de modo que todos los amortiguadores de un mismo compartimento van a variar conjuntamente ante un cambio en el pH. Esto nos va a permitir conocer los cambios de cada sistema si conocemos los que ha experimentado uno de ellos. En la clínica el sistema que se mide para la valoración del estado ácido-base es el sistema carbónico/bicarbonato.
1.10. Sistemas de compensación
Ninguno de los sistemas de amortiguación de pH que acabamos de ver es capaz de eliminar del organismo los hidrogeniones en exceso ya que van a intervenir de forma inmediata minimizando, pero no impidiendo cambios en el pH, por lo que es necesario inducir posteriores respuestas compensatorias pulmonar y renal.
1.10.1. Compensación respiratoria
La respiración elimina CO2, que como hemos visto equivale a eliminar un ácido, el carbónico. La acidosis, lo mismo por un aumento de CO2, que, por ácidos fijos, es un estímulo para la ventilación. La respuesta ventilatoria ante los cambios de pH es rápida. Está mediada por los quimiorreceptores de los corpúsculos carotídeos y aórticos y del centro respiratorio bulbar. El descenso de pH estimula a los quimiorreceptores provocando una hiperventilación, aumentando la eliminación de CO2 y disminuyendo la pCO2 arterial. La acción de los pulmones para compensar trastornos no dependientes de anormalidades de la función respiratoria se inicia, como la de los tampones, inmediatamente, pero tarda varias horas en alcanzar la eficacia plena. También es limitada, porque la ventilación sólo puede aumentar y, sobre todo, disminuir hasta cierto punto, por lo que precisa la ayuda del riñón para la compensación completa.
El aumento de pH inhibe los quimiorreceptores provocando un descenso rápido de la ventilación, una reducción de la eliminación de CO2, y por tanto una elevación de la pCO2 arterial. Es menos eficaz porque se acompaña de una disminución de la pO2 que estimula el centro respiratorio.
1.10.2. Compensación renal
El riñón es el principal órgano implicado en la regulación del equilibrio ácido-base por dos motivos fundamentales:
- Es la principal vía de eliminación de la carga ácida metabólica normal y de los metabolitos ácidos patológicos.
- Es el órgano responsable de mantener la concentración plasmática de bicarbonato en un valor constante, gracias a su capacidad para reabsorber y generar bicarbonato de modo variable en función del pH de las células tubulares renales.
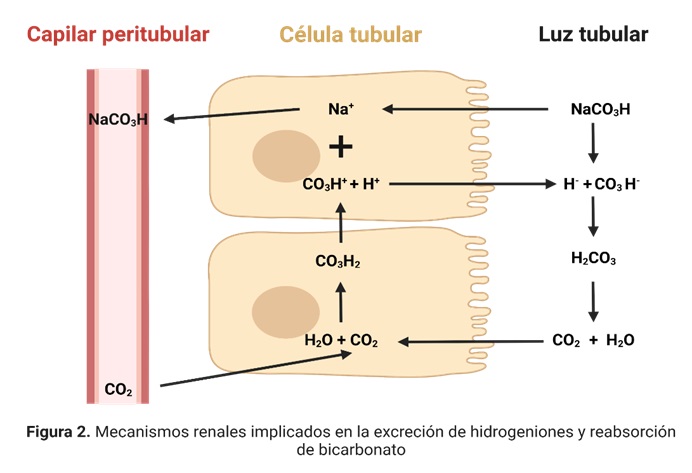
1.10.2.1 Reabsorción renal de bicarbonato
Los riñones reabsorben la mayor parte de los mEq de HCO3– que filtran diariamente. El bicarbonato es filtrado continuamente hacia la luz del túbulo renal (generalmente asociado a iones Na+) de modo que en el filtrado glomerular intacto la concentración de bicarbonato es prácticamente igual a la del plasma, de ahí la importancia del proceso de reabsorción de este.
Los iones bicarbonato filtrados se reabsorben por la interacción con iones hidrógeno en los túbulos. El efecto neto es una reabsorción de bicarbonato. Los iones bicarbonato que realmente pasan al líquido extracelular no son los mismos que se filtraron a los túbulos. Los iones bicarbonato se «titulan» en los túbulos frente a los iones H+. En condiciones normales, las cantidades de estos dos iones que penetran en los túbulos son casi iguales y se combinan entre ellos para formar CO2 y H2O. Cuando existe un exceso de iones bicarbonato respecto a la de iones H+en la orina -alcalosis metabólica- el bicarbonato no se reabsorbe y se excreta en la orina. En la acidosis, por el contrario, existe un exceso de iones H+ con respecto a la de iones bicarbonato, lo que hace que la reabsorción de bicarbonato sea completa.
1.10.2.2. Producción renal de Bicarbonato
Si a pesar del proceso de reabsorción la concentración de bicarbonato plasmático permanece por debajo del valor normal, en las células tubulares se va a sintetizar bicarbonato. Esto sucede fundamentalmente en el túbulo contorneado distal a partir del CO2 procedente de la sangre o del propio metabolismo de la célula tubular por acción de la anhidrasa carbónica. El H2CO3 así generado se disocia en bicarbonato, que se reabsorbe hacia la sangre, y un hidrogenión, que es eliminado. En este caso los hidrogeniones sí van a acidificar la orina, de ahí la gran importancia de los amortiguadores urinarios.
Aproximadamente un tercio de los H+secretados van a ser titulados sobre fosfato y el resto sobre amoníaco, siendo por tanto mínima la cantidad de ácido libre que se elimina por la orina.
La producción renal de amoníaco representa aproximadamente un 60% en la eliminación de H+asociada a ácidos no volátiles. Este se va a producir principalmente por desaminación de la glutamina en las células del túbulo renal y difunde fácilmente a través de la membrana hacia la luz del túbulo donde, se combina con H+formando iones amonio, un ácido muy débil que es eliminado por la orina.
Llamamos acidez titulable de la orina a la que se puede medir, lo cual no indica el total de H+secretados, ya que los iones amonio, por su debilidad, prácticamente no contribuyen a la acidez titulable, y los H+amortiguados con bicarbonato se van a eliminar formando parte de una molécula de agua. Por este motivo la acidez titulable corresponde casi en su totalidad a los hidrogeniones que se encuentran como fosfato.
¡Recuerda!
A pesar de la gran cantidad de hidrogeniones que se generan diariamente en el metabolismo humano, el pH (que representa el logaritmo inverso de la concentración de hidrogeniones) se mantiene constante. Los iones medibles séricos se representan por el anión gap definido como la diferencia entre la concentración de sodio y las de cloro y bicarbonato, cuyo valor normal se sitúa entre 8 y 16 mEq/L y cuyo aumenta indica un incremento en la concentración de cationes que no han sido medidos directamente. El principal ácido del organismo es el CO2, ácido volátil que se elimina por los pulmones y que representa el 98%, mientras que el 2% restante (ácidos fijos) se deben eliminar por los riñones.
Ante los cambios de pH el organismo reacciona de forma que intenta compensarlo por medio de tres sistemas:
- Los amortiguadores o tampones, formados por ácidos débiles y su base conjugada (hemoglobina, fosfato, el carbonato óseo y el carbónico/carbonato);
- El sistema de compensación pulmonar, que mediante la mayor o menor eliminación de CO2 debido a la estimulación o inhibición de los quimiorreceptores por la pCO2 sérica; y
- La compensación renal, mediante la reabsorción de HCO3– y la producción renal de amoníaco. Se denomina acidez titulable de la orina a aquella que se puede medir en la orina y que corresponde prácticamente en su totalidad a la que se halla en forma de fosfato, dado que la cantidad eliminada en forma de amonio y de hidrogeniones amortiguados con bicarbonato es mínima
2. Actividades en clase
2.1. Materiales
• Potenciómetro calibrado para la medición de pH.
• Soluciones tampón de pH 4.0, 7.0 y 10.0 para calibración del potenciómetro.
• Vasos y tubos recolectores para muestras de orina (a) y saliva (b).
• Guantes desechables y materiales de higiene (toallitas, gel desinfectante, etc.).
• Cronómetro o temporizador.
• Registro para anotar los datos obtenidos.
• Equipo básico para realizar ejercicio (por ejemplo, cuerda para saltar o espacio para trotar en el lugar).
• Higiene personal: Asegúrese de que los participantes no hayan ingerido alimentos ni bebidas en los últimos 30 minutos, ya que esto puede alterar el pH de la saliva y la orina.

2.2 Calibración del potenciómetro
a) Limpiar el electrodo con agua destilada y secar con papel absorbente, tener mucho cuidado al tocar la punta del electrodo.
b) Sumerja el electrodo en la solución tampón de pH 4.0 y ajuste el potenciómetro hasta que marque el valor correcto, es importante que la punta del electrodo no toque el fondo del recipiente de la solución.
c) Realice el mismo procedimiento con las soluciones de pH 7.0 y 10.0 para confirmar la calibración.
2.3 Procedimiento experimental
2.3.1 Condiciones basales
Indique al participante que tome asiento y se encuentre relajado y respire de manera normal durante al menos 5 minutos para estabilizar su estado basal.
Recolección de muestras:
- Pida al participante que recolecte una muestra de saliva en un tubo recolector. Asegúrese de que evite la contaminación con residuos de comida o bebida.
- En caso de medir orina, el participante debe recolectar una pequeña muestra reciente en un vaso o tubo estéril.
Medición del pH basal:
- Enjuague el electrodo del potenciómetro con agua destilada.
- Introduzca el electrodo en la muestra de saliva u orina y registre el valor de pH.
2.3.2 Estado de hiperventilación
Indique al participante que hiperventile durante 1 minuto y medio si el participante se siente mareado suspenda la hiperventilación.
Recolección de muestras:
a) Una vez que el participante ha hiperventilado, pida que recolecte una muestra de saliva en un tubo recolector. Asegúrese de que evite la contaminación con residuos de comida o bebida.
b) Si es necesario medir el pH de la orina, el participante debe recolectar una pequeña muestra reciente en un vaso o tubo estéril.
Medición del pH post hiperventilación:
Enjuague el electrodo del potenciómetro con agua destilada.
a) Introduzca el electrodo en el nuevo fluído recolectado.
2.3.3 Estado de post ejercicio
Indique al participante que realice 3 minutos de ejercicio a libre elección (sentadillas, jumping jacks, abdominales, trote ligero, uso de bicicleta estática si hay en el laboratorio y está disponible etc.)
Recolección de muestras:
a) Una vez que el participante ha realizado 3 min de ejercicio, pida que recolecte una muestra de saliva en un tubo recolector. Asegúrese de que evite la contaminación con residuos de comida o bebida.
b) Si es necesario medir el pH de la orina, el participante debe recolectar una pequeña muestra reciente en un vaso o tubo estéril.
Medición del pH post ejercicio:
a) Enjuaga el electrodo del potenciómetro con agua destilada.
b) Introduzca el electrodo en el nuevo fluido recolectado.
2.4 Discusión de resultados
Discuta con sus académicos los resultados sobre la regulación del pH renal y a nivel salival durante condiciones de alcalosis respiratoria.
La siguiente tabla le puede ser de utilidad para presentar sus resultados:
|
|
Saliva |
Orina |
||||
|
Participante |
pH basal |
pH hiperventilación |
pH ejercicio |
pH basal |
pH hiperventilación |
pH ejercicio |
|
1 |
|
|
|
|
|
|
|
2 |
|
|
|
|
|
|
|
3 |
|
|
|
|
|
|
|
4 |
|
|
|
|
|
|
Referencias:
- Julia-Sánchez S, Álvarez-Hermsa J, Urdampilletab A, Corbic F, Pagèsa T y Viscora G. Efecto del ejercicio anaeróbico láctico sobre el pH salival. Apunts Med Esport. 2013;48(179):83—88
- Foster GT, Vazir ND, Sassoon CS Alcalosis respiratoria, Respir Care. 2001 Abr;46(4):
- El texto del marco teórico se basa en la información recuperada de: Fundación para la Formación e Investigación Sanitarias de la Región de Murcia. Sección Volviendo a la básico. Tema 7. Fundamentos del equilibrio ácido-base. Disponible en línea en: http://www.ffis.es/volviendoalobasico/ 2definiciones_y_conceptos_generales.html
- Hall, J. E. (2016). Guyton y Hall. Tratado de fisiología médica. 13ª edición. Barcelona, España: Elsevier.
- Silverthorn, D. U. (2019). Fisiología humana: un enfoque integrado. 8ª edición. Ciudad de México, México: Editorial Médica Panamericana.
Referencias:
Esta obra está bajo una
Licencia Creative Commons
Atribución 4.0 Internacional

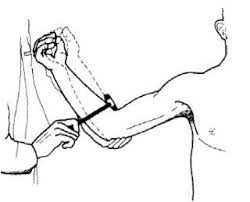 Reflejo bicipital: Se sujeta el codo del participante a 90 grados de flexión con el brazo ligeramente en pronación, y se procede a percutir el tendón a través del pulgar y la respuesta normal es la flexión del codo. Se debe realizar de manera bilateral.
Reflejo bicipital: Se sujeta el codo del participante a 90 grados de flexión con el brazo ligeramente en pronación, y se procede a percutir el tendón a través del pulgar y la respuesta normal es la flexión del codo. Se debe realizar de manera bilateral.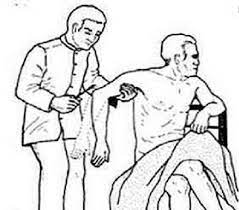





Comentarios recientes