Objetivo de aprendizaje
- Describe el potencial de acción cardiaco, el sistema de conducción cardiaco y las propiedades contráctiles y excitatorias del músculo cardiaco.
Resultado de aprendizaje
- El estudiante analiza los mecanismos fisiológicos implicados en el potencial de acción y contractilidad del tejido cardiaco
Glosario de términos
Arterias: Vaso sanguíneo que conduce la sangre desde el corazón a las diversas partes del organismo.
Corazón: Órgano del tamaño aproximado de un puño. Está compuesto de tejido muscular y bombea sangre a todo el cuerpo.
Ca2+: Ion de calcio
Ca2+ tipo L: Canales de calcio lentos
Cardiomegalia: Crecimiento del corazón que se ve en cualquier prueba por imágenes, incluida una radiografía de tórax. Se puede medir a través del índice cardiotorácico.
K+: Ion de potasio
Na+: Ion de sodio
Marcapaso: En cardiología, es el nodo (sinusal) que genera el potencial de acción para contraer el músculo cardiaco y es el responsable de la frecuencia cardiaca.
Marcapaso ectópico: Aquel que aparece en un lugar diferente al nódulo sinusal.
Venas: Son los vasos sanguíneos situados por todo el cuerpo que recogen y transportan sangre pobre en oxígeno hacia el corazón.
Potencial de acción (PA) cardiaco: El potencial de acción cardíaco corresponde a una rápida despolarización de la membrana, seguida de la repolarización hasta el potencial de membrana en reposo en la fibra miocárdica.
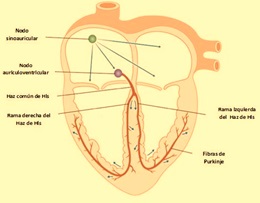
Sistema de conducción cardiaco: Es el tejido especializado que conduce el potencial de acción del nodo sinoatrial (SA) al músculo cardiaco. Se encuentra conformado por a) nodo SA, b) haces internodales, c) nodo AV, d) Haz de His, e) Red de Purkinje.
- Introducción
El corazón es un órgano muscular ubicado en la cavidad torácica que consiste en dos bombas. La bomba derecha impulsa la sangre por los vasos donde se intercambian los gases en los pulmones. La izquierda impulsa la sangre por los vasos que irrigan los diferentes tejidos del organismo. Cada lado del corazón se divide en dos cámaras, una aurícula y un ventrículo.
Los impulsos cardíacos que generan la contracción miocárdica tienen su origen en el nodo sinoauricular, el cual se ubica en la aurícula derecha, donde se conduce el potencial de acción a través de los haces internodales hasta llegar al nodo auriculoventricular, de donde se propaga el potencial de acción por las fibras de Purkinje a toda la superficie ventricular.
El potencial de acción cardíaco corresponde a una rápida despolarización de la membrana, seguida de la repolarización hasta el potencial de membrana el cual se puede registrar mediante un electrodo intracelular. Este potencial como ya se mencionó previamente se origina en el nodo sinoauricular, y se propaga por todo el músculo cardíaco a través del sistema de conducción mediante uniones hendidura. Este nodo, al ser el primer sitio donde se generan potenciales de acción, determina la frecuencia cardiaca.
El potencial de acción cardíaco difiere de forma significativa en diferentes porciones del corazón dependiendo de la cinética de los canales que tengan las células en dichas regiones (Fig 1). Por ejemplo, en los cardiomiocitos de las paredes auriculares y ventriculares la fase de despolarización o fase 0 es muy rápida, (a estas células se les denomina de respuesta rápida), mientras que en las células marcapaso del tejido de conducción la fase 0 de despolarización ocurre a menor velocidad (células de respuesta lenta).
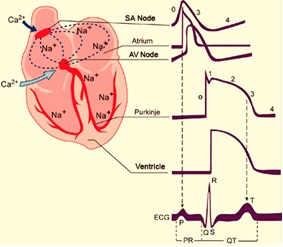
Figura 1. Morfología de los potenciales de acción dependiendo de la región anatómica en que se registran: Nodo SA, músculo auricular, nodo AV, fibras de Purkinje, músculo ventricular. Y en el último registro se observa su relación temporal con el registro de electrocardiograma (https://www.itaca.edu.es/potencial-accion-cardiaco.htm)
El potencial de acción se divide en cinco fases (Fig. 2): En una fibra rápida, la fase ascendente rápida del potencial de acción se denomina fase 0. La cual va seguida de un breve período de repolarización parcial precoz (fase 1) y de una fase de meseta (fase 2), que persiste durante 0,1-0,2 segundos. Después, la membrana se repolariza (fase 3) hasta que se recupera de nuevo el estado de reposo de la polarización (fase 4).
Las células de respuesta lenta, por ejemplo, las células del sistema de conducción (Fig. 2B), tienen una función de marcapaso y se diferencian de las de respuesta rápida ya que, la corriente ascendente o de despolarización (fase 0) es más lenta, no presentan una fase de repolarización precoz (o Fase 1) ni una fase de meseta (Fase 2), presentan una fase de repolarización (Fase 3). Finalmente, el potencial de membrana en reposo (Fase 4) en las células de respuesta lenta es menos negativo que en las de respuesta rápida, de hecho, no presentan un potencial de membrana en reposo verdadero, sino que este aumenta lentamente su voltaje a partir del punto de mayor electronegatividad (Potencial diastólico máximo) hasta el inicio de la despolarización (Fase 0).
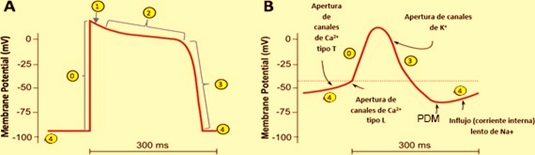
Figura 2. Morfología de un potencial de acción en una fibra rápida, por ejemplo, en los cardiomiocitos (A) y nodo sinoauricular (B).
Las diversas fases del potencial de acción cardíaco se asocian con cambios en la permeabilidad de la membrana celular, lo que produce corrientes iónicas que modifican el voltaje de la membrana (Fig. 3). Por ejemplo, en las fibras rápidas: la fase 0, corresponde a la apertura de canales de Na+; la fase 2, corresponde a la apertura de canales tipo L de Ca++ y la fase 3 corresponde a la apertura de canales de K+.
Nótese que en el potencial de acción de las fibras lentas (marcapasos), los cambios en el voltaje de cada fase se asocian a cambios en la permeabilidad de la membrana celular a diferentes iones .
Una vez que el músculo ventricular se ha activado eléctricamente, desarrolla refractariedad a una activación adicional. Este periodo refractario efectivo surge porque los canales de Na+ dependientes de voltaje responsables de la despolarización (fase 0), se inactivan temporalmente como consecuencia de la despolarización de la membrana. El periodo refractario efectivo es análogo al periodo refractario absoluto en el nervio y en el músculo esquelético. Durante el periodo refractario efectivo un estímulo eléctrico adicional no puede producir un potencial de acción.
Al final de la meseta (fase 2) las células empiezan a repolarizarse a medida que aumenta la permeabilidad al K+ y disminuye la del Ca++. El periodo refractario relativo se inicia a medida que los canales de Na+ dependientes de voltaje empiezan a recuperarse de la inactivación. Durante este periodo sólo estímulos supraumbrales pueden generar un potencial de acción. La refractariedad le proporciona al corazón una medida de seguridad eléctrica, ya que impide que marcapasos ectópicos se generen. Una vez que se inicia un potencial de acción en el nodo sinoauricular, la actividad eléctrica se conduce por la musculatura atrial y posteriormente hacia la musculatura ventricular a través del nodo aurículo-ventricular (fig. 4).
Figura 4. Sistema de conducción eléctrico del corazón humano: Nodo sinoauricular (SA), nodo auriculoventricular (AV), haz de His (común y ramas derecha e izquierda), y red subendocárdica o de Purkinje.
- Actividad en clase
2.1. Efecto de fármacos sobre el potencial de acción ventricular
Los tres canales principales estudiados hasta ahora, Na+, K+ y Ca2+, son todos necesarios para que se genere con éxito un potencial de acción. Si uno o todos estos canales son bloqueados por la administración de un fármaco bloqueador de canales, los efectos sobre el potencial de acción se ven fácilmente. El canal de Na es necesario para el inicio del potencial de acción, y si está completamente bloqueado no se forma ningún potencial de acción. Uno de los canales responsables de la fase de repolarización de un potencial de acción es IKr (canal rápido de potasio). Si IKr está completamente bloqueado, la célula se repolariza mucho más lentamente y la duración del potencial de acción será más larga. El canal de calcio es responsable de la entrada de calcio en la célula, que a su vez libera calcio de las reservas intracelulares en el retículo sarcoplásmico y da como resultado una contracción de la célula, y puede verse en la fase de meseta del PA. Si el canal de Ca está completamente bloqueado, entonces la fase de meseta del PA se vuelve mucho más pequeña y la duración del PA es más corta.
Materiales:
Para el desarrollo de la práctica, usaremos el programa LabHEART 5.3 desarrollado por la Universidad de California en Davis (UCD), el cual se encuentra disponible en la computadora de tu Laboratorio.
Procedimiento:
1. Abre el programa LabHeart que se encuentra en la computadora del Laboratorio.
2. Desde el menú de inicio, haga clic en Waveform (forma de onda) y luego elija Run Continuously (ejecutar continuamente):
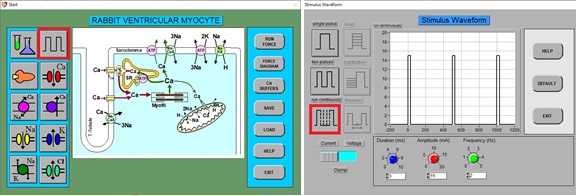
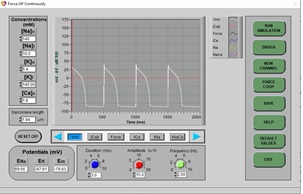
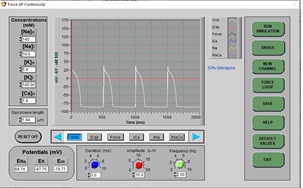
3. Haga clic en RUN (ejecutar), debería ver un ciclo continuo de 4 PA normales:
4. Detenga la simulación con el botón superior (cambiará de color):
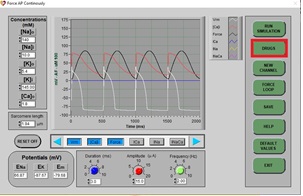
5. Ahora, haga clic en DRUGS (fármacos) y aparecerá la siguiente pantalla:
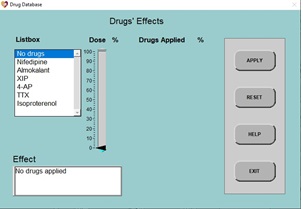
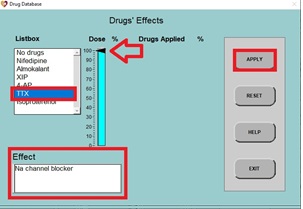
6. Primero, veremos el efecto de bloquear completamente los canales de sodio:
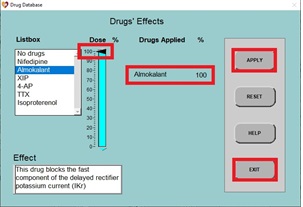
a) Haga clic en TTX (un bloqueador de canales de Na+, como se puede ver en el panel inferior izquierdo), luego haga clic en el control deslizante, establezca el porcentaje de dosis en 100% y haga clic en APPLY (aplicar) y luego EXIT (salir).
 b) Después de algunos ciclos (aproximadamente 3 barridos de pantalla), el nuevo PA se dibujará en la pantalla. Tenga en cuenta que el potencial de acción no es mucho más que una «joroba» en la pantalla.
b) Después de algunos ciclos (aproximadamente 3 barridos de pantalla), el nuevo PA se dibujará en la pantalla. Tenga en cuenta que el potencial de acción no es mucho más que una «joroba» en la pantalla.
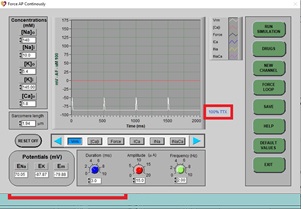
c) ¿Por qué crees que el PA tiene esta forma?
A continuación, veremos el efecto de bloquear completamente los canales rápidos de potasio:
7. Haga clic en DRUGS, siguiente, haga clic en RESET (restablecer) y EXIT. Haga clic en STOP (detener) y luego en RUN. Esto restablecerá todos los efectos de las drogas y volverá a dibujar un PA normal. Espere unos segundos (aproximadamente 3 barridos de pantalla) para que el PA normal se dibuje en la pantalla.
8. Cuando se vuelva a dibujar el PA normal, haga clic en DRUGS, haga clic en Almokalant (un bloqueador rápido de los canales de potasio), luego haga clic en el control deslizante y establezca el porcentaje de dosis en 100% y haga clic en APPLY y EXIT.
a) Después de unos segundos (aproximadamente 3 barridos de pantalla), el nuevo PA se dibujará en la pantalla. Observe que el potencial de acción ahora es más largo que antes.
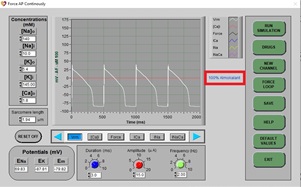 b) Responde: Si el canal IKr está completamente bloqueado, ¿cómo puede repolarizarse la célula?
b) Responde: Si el canal IKr está completamente bloqueado, ¿cómo puede repolarizarse la célula?
9.Ahora, veremos el efecto de bloquear progresivamente los canales de Ca2+:
a) Haga clic en DRUGS. A continuación, haga clic en RESET y EXIT. Haga clic en STOP y luego en RUN. Esto restablecerá todos los efectos de las drogas y volverá a dibujar un PA normal. Espere unos segundos (aproximadamente 3 barridos de pantalla) para que el PA normal se dibuje en la pantalla.
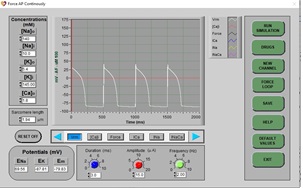
b) Cuando se vuelva a dibujar el PA normal, haga clic en DRUGS, haga clic en Nifedipina (un bloqueador de canales de calcio tipo L), luego haga clic en el control deslizante y establezca el porcentaje de dosis en 50% y haga clic en APPLY y EXIT.
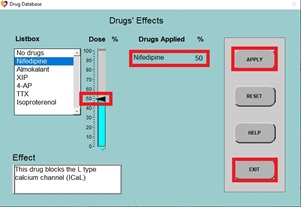
c) Después de unos segundos, el nuevo PA se dibujará en la pantalla. Tenga en cuenta que el potencial de acción es ahora más corto que antes, y la fase de meseta es mucho más pequeña que durante un potencial normal.
 d) Haga clic en DRUGS y repita el procedimiento con una dosis de nifedipina de 80% y luego 100%.
d) Haga clic en DRUGS y repita el procedimiento con una dosis de nifedipina de 80% y luego 100%.
 e) Responde: Cuando los canales de calcio están completamente bloqueados (porcentaje de dosis de nifedipina del 100%), ¿todavía hay una fase de meseta en el PA? Si es así, ¿por qué? Si no, ¿por qué no? ¿Puede el calcio ingresar a la célula de otra manera que no sea a través de los canales de calcio? Explica tu respuesta.
e) Responde: Cuando los canales de calcio están completamente bloqueados (porcentaje de dosis de nifedipina del 100%), ¿todavía hay una fase de meseta en el PA? Si es así, ¿por qué? Si no, ¿por qué no? ¿Puede el calcio ingresar a la célula de otra manera que no sea a través de los canales de calcio? Explica tu respuesta.
10. Por último, probaremos el efecto de un agonista adrenérgico sobre el potencial de acción ventricular.
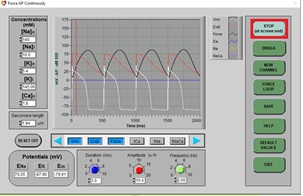
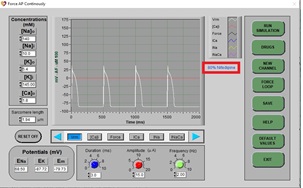
a) Haga clic en DRUGS. A continuación, haga clic en RESET y EXIT. En esta ocasión, seleccione [Ca]i y Force para tener una representación de la concentración intracelular de calcio y la fuerza de contracción generada, respectivamente. Haga clic en STOP y luego en RUN para dibujar un PA normal (espere aproximadamente 3 barridos de pantalla). Debe mostrarse una gráfica compuesta como la siguiente (la flecha roja muestra los trazos generados para la concentración intracelular de calcio, de color rojo, y la fuerza de contracción, en negro):
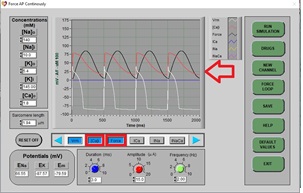 b) Haga clic en DRUGS, haga clic en Isoproterenol (un agonista beta-adrenérgico no selectivo), luego haga clic en el control deslizante y establezca el porcentaje de dosis en 50% y haga clic en APPLY y EXIT.
b) Haga clic en DRUGS, haga clic en Isoproterenol (un agonista beta-adrenérgico no selectivo), luego haga clic en el control deslizante y establezca el porcentaje de dosis en 50% y haga clic en APPLY y EXIT.
c) Después de unos segundos, el nuevo PA se dibujará en la pantalla:
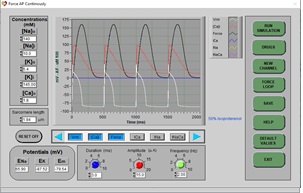 d) La amplitud de la curva Force se duplicó (esto representa lo que ocurre durante la estimulación simpática a las células ventriculares). ¿Cuál es el mecanismo que participa en la generación de la fuerza de contracción? ¿Qué explica el aumento de la fuerza de contracción generada?
d) La amplitud de la curva Force se duplicó (esto representa lo que ocurre durante la estimulación simpática a las células ventriculares). ¿Cuál es el mecanismo que participa en la generación de la fuerza de contracción? ¿Qué explica el aumento de la fuerza de contracción generada?
e) ¿Cuáles son las implicaciones funcionales ocasionadas por la estimulación beta adrenérgica por el isoproterenol?
f) Finalmente, observa cómo aumenta la pendiente de descenso de la curva de concentración de calcio al final de cada potencial de acción. ¿Cómo se explica esto? ¿Qué estructura (canal o bomba) está implicada en este efecto?
11. Discute en clase los resultados de la práctica y elabora un reporte.
2.2 Viñeta clínica
Paciente masculino de 56 años, que, como protocolo para una intervención quirúrgica oftalmológica de cataratas, se le realizó una radiografía de tórax. Como hallazgo incidental en dicho estudio imagenológico, se observa una marcada cardiomegalia.
Como estudio complementario para la cardiomegalia, se le realiza un ecocardiograma, el cual revela dilatación de ambos ventrículos cardiacos, dilatación de la aurícula izquierda, insuficiencia en la válvula mitral de grado moderado y un compromiso significativo en la fracción de eyección del ventrículo izquierdo, confirmándose así, el diagnóstico de miocardiopatía dilatada. Como actualmente es asintomática su enfermedad, se le da de alta explicándole signos de alarma, que, de presentarse, debe acudir inmediatamente al hospital.
Días después, el paciente ingresa al hospital con síntomas de insuficiencia cardiaca descompensada izquierda (disnea, cansancio, falta de energía, y tos con esputo de color “asalmonado”). Posteriormente se le realizaron diversos estudios para encontrar la etiología de esta enfermedad.
En sus laboratorios tomados en el hospital, solo se encontraron alteraciones en los niveles de calcio sérico (extracelular) con valores de 3.9 mg/dL (valores normales 8.5 – 10.2 mg/dL) y en los valores de parathormona (PTH) 8.1 pg/ml (valores normales 10 – 55 pg/ml) *. Confirmándose los diagnósticos de hipocalcemia crónica secundaria a hipoparatiroidismo. [1]
Con los datos brindados sobre el padecimiento, responde las siguientes preguntas:
- ¿Cómo interactúa el calcio intracelular en el proceso de contracción del músculo cardiaco al nivel de las miofibrillas?
- ¿Cómo se encuentran los valores de calcio extracelular?
- El calcio es un ion estrictamente regulado, por lo que, para presentar afecciones cardiacas, el proceso homeostático debe estar alterado por un largo periodo de tiempo. ¿Cuál crees que sea la razón por la que el paciente presenta este padecimiento cardiaco?
- ¿Qué fase del potencial de acción cardiaco se verá afectada?
- Explica el mecanismo por el cual se ve afectada la fuerza de contracción del músculo cardiaco.
- El tratamiento para resolver la sintomatología sería administrar calcio intravenoso. Explica el fundamento fisiológico por el cual este es el tratamiento de elección.
Después de analizar los estudios de laboratorio, se le decide suplementar con calcio (además de vitamina D3 para mejorar la absorción de este electrolito), así como un fármaco nuevo denominado “levosimendán”**. Dicho fármaco es el primer representante de una nueva clase farmacológica llamada “inodilatadores” que mejora el estado hemodinámico de los pacientes con insuficiencia cardiaca descompensada. Su mecanismo de acción es el siguiente: Potencia la sensibilidad al calcio de las proteínas contráctiles mediante la unión a la troponina C cardiaca, por un mecanismo dependiente de calcio. Aumenta la fuerza de contracción, pero sin afectar a la relajación ventricular.[2]
- Explica el mecanismo por el cual el levosimendán mejora la fuerza de contracción del músculo cardiaco en el paciente.
Notas:
*La parathormona u hormona paratiroidea es una hormona secretada por la glándula paratiroides que interviene en la regulación del calcio y del fósforo. Su función es regular la concentración de los iones calcio en el líquido extracelular aumentando la resorción ósea al estimular a los osteoclastos para reabsorber el hueso, lo que libera calcio al torrente sanguíneo.
**El levosimendán además abre los canales de potasio sensibles al ATP en el músculo liso vascular, lo que propicia la vasodilatación de los vasos arteriales de resistencia sistémicos y coronarios. Por lo que, en pacientes con fallo cardiaco, las acciones inotrópica positiva y vasodilatadora del levosimendán producen un aumento de la fuerza contráctil y una reducción tanto de la precarga como de la poscarga, sin afectar de forma negativa a la función diastólica.
- Referencias
- Bers, D. M. y Puglisi, J. L. Workbook for LabHEART 5.3. Disponible en línea en: http://www.labheart.org/index.php?site=download.php (fecha de consulta: 26 de octubre de 2021).
- Johnson R, Toloza J, Cortés L, Valdés C (2010). Miocardiopatía por hipocalcemia. Revista Chilena Cardiología; 29: 374-377.
- Carretero M. (2006) Levosimendán. Mejora del estadio hemodinámico de los pacientes con insuficiencia cardiaca descompensada. OFFARM Elsevier, Vol. 25, Núm. 8: 120-122.
- Zhang W, Xue F, Bu Q, Liu X. Hypocalcemic cardiomyopathy after parathyroidectomy in a patient with uremia: A case report and literature review. J Int Med Res. 2020 Jul;48(7)
Esta obra está bajo una
Licencia Creative Commons
Atribución 4.0 Internacional



Comentarios recientes