Objetivo de aprendizaje
Explicar el movimiento de iones y agua a través de la membrana celular como un concepto fundamental de la fisiología.
Resultado de aprendizaje
Explica los términos de difusión y ósmosis a través de la experimentación.
Discute las características estructurales de la membrana celular y los mecanismos de transporte a través de ella.
Glosario de términos
Difusión: Es el fenómeno en el que las moléculas en disolución se desplazan a favor de un gradiente de concentración, no requiere una membrana.
Difusión simple: Es el fenómeno en el que las moléculas o iones pasan directamente a través de la membrana, a favor del gradiente de concentración.
Difusión facilitada: Es el fenómeno en el que se requieren proteínas transmembranales para que algunas moléculas puedan difundir a favor de un gradiente de concentración, no requiere energía.
Ósmosis: Se define como el paso de agua desde una solución de baja concentración de soluto hacia una solución de alta concentración de soluto, separadas ambas soluciones por una membrana semipermeable.
Ion: Son átomos o grupos de átomos que tienen una carga eléctrica. Los iones con una carga positiva se denominan cationes y los que tienen carga negativa se denominan aniones.
Osmolaridad: Es la medida usada para expresar la concentración total de sustancias en disoluciones (osmoles/litro). En un organismo normal la concentración está alrededor de 290 miliosmoles.
Osmolalidad: Es la concentración molar del conjunto de moléculas osmóticamente activas en un kilogramo de solvente.
Ecuación de Van´t Hoff: Se utiliza para medir la presión osmótica.
π = nCRT
Donde: n= número de partículas disociales por molécula, C = concentración total de solutos, R = constante de los gases, T = temperatura en grados Kelvin.
-
- Introducción
Debido a sus características fisicoquímicas, el agua se considera como el disolvente universal. En los sistemas biológicos, esta premisa es importante ya que el agua corresponde al principal componente. En el varón adulto promedio, el agua constituye del 50 al 70 % de la masa o peso corporal total (PCT). Dicho porcentaje se puede dividir en líquido intracelular (LIC = 40% del PCT) y líquido extracelular (LEC = 20 % del PCT), subdividida a su vez en agua plasmática (5% del PCT) y agua intersticial (15% de PCT), esto se puede observar en la figura 1.
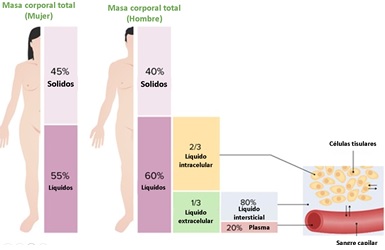
Figura 1. Distribución de agua en los compartimientos corporales. Los hombres tienen aproximadamente 60% de agua en el organismo, mientras que las mujeres tienen un mayor porcentaje rondando el 55%. De esta cantidad de agua, 2/3 corresponderán a LIC y 1/3 a LEC, del cual el 80% se encontrará en el líquido intersticial y 20% en el plasma.
El contenido de agua y solutos en estos compartimentos no es estático, cambian debido a su movimiento por los procesos de difusión (solutos) y ósmosis (solvente).
El transporte de solutos se clasifica en pasivo si no requiere energía metabólica o activo si requiere la hidrólisis de ATP. La difusión simple y facilitada son ejemplos de transporte pasivo; mientras que, el transporte activo se divide en primario o secundario (figura 2).
La difusión simple es el proceso por el cual un gas o un soluto disuelto se expande como consecuencia del movimiento aleatorio (energía cinética) de sus moléculas hasta llenar todo el espacio disponible, por lo cual no requiere atravesar una membrana.
La difusión facilitada ocurre cuando un soluto difunde a través de una membrana semipermeable gracias a proteínas transportadoras a favor de su gradiente de concentración, de lo contrario, sólo será posible su traslado por medio de transporte activo.
Por otro lado, el movimiento neto de agua a través de la membrana semipermeable se conoce como ósmosis. Este movimiento requiere un gradiente de concentración de solutos, de tal manera, que el paso de agua irá del lugar donde hay menos solutos a donde hay más.
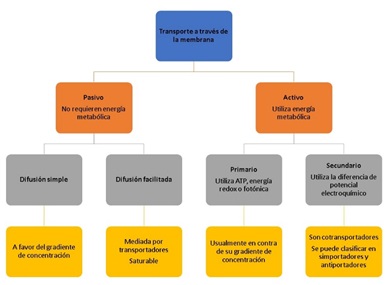
Figura 2. Diagrama que esquematiza los diferentes tipos de transporte. El transporte de partículas se puede clasificar en pasivo si no requiere energía metabólica y activo si utilizará energía. Dentro del transporte pasivo podemos describir a la difusión simple y facilitada. El transporte activo se puede clasificar como primario o secundario.
El movimiento de agua a través de la membrana plasmática determina el volumen celular. La regulación de dicho volumen es muy importante, ya que las células animales no pueden soportar la entrada de grandes cantidades de agua, debido a que entran en un estado de turgencia (es decir, se hinchan), e inclusive, pueden llegar a lisarse (explotar). Si una célula es colocada en un medio con una concentración de solutos mayores (hipertónico) que aquellos que hay en el espacio intracelular y la membrana es poco permeable a dicho soluto, el agua intracelular saldrá de la célula. En cambio, si es colocada en una solución con menor concentración de solutos (hipotónico) en comparación con los que están presentes en el interior celular, el agua de la solución entrará en la célula (figura 3). El movimiento del agua en estas condiciones se denomina ósmosis, la presión necesaria para evitar dicho movimiento se denomina presión osmótica (ecuación de Van´t Hoff, encontrada en el glosario).
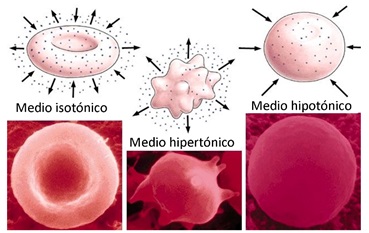
Figura 3. Ejemplo de ósmosis en los eritrocitos en diferentes medios con distinta tonicidad. La tonicidad es la osmolaridad de una solución comparada con la osmolaridad del plasma.
Los solutos que promueven el movimiento de agua de un lado al otro de la célula son denominados osmóticamente activos. Es importante aclarar que la cantidad de partículas osmóticamente activas no siempre es igual a la concentración de dicho soluto. Por ejemplo, la sal común (cuya fórmula química es NaCl) tiene por cada molécula de sal dos partículas osmóticamente activas, los iones sodio y cloruro. La cantidad de partículas osmóticamente activas por litro de agua se denomina osmolaridad. Recordemos que el agua es una molécula anfipática, lo que quiere decir que tiene una carga negativa (O–) y positiva (H+) por lo que puede ser atraída por cargas tanto positivas como negativas.
Los iones que se mueven a través de la membrana celular además poseen carga eléctrica, el Na+ por ejemplo tiene carga positiva, mientras que el Cl– está cargado negativamente. Los iones presentes al interior y exterior celular se encuentran por lo tanto en diferente concentración química y con diferentes cargas eléctricas. La diferencia de concentración química en ambos lados de la membrana promueve el movimiento de los iones, generando así cambios rápidos en las cargas acumuladas a ambos lados de la membrana (polarización de la membrana), dichos cambios provocan una diferencia de voltaje que se conoce como potencial de membrana. Así, el movimiento de los iones provoca un potencial de membrana generado por difusión.
- Actividades en la sesión
Se recomienda dividir al grupo en equipos para que cada equipo realice un experimento, o en su caso seleccionar alguno de los experimentos para trabajar de forma grupal y favorecer el desarrollo del resultado de aprendizaje.
Experimento 1. Factores que influyen en la difusión de una molécula en solución: Temperatura
Material: 2 vasos de plástico transparente, agua destilada a temperatura ambiente, agua destilada caliente y colorante líquido.
En un vaso de precipitados coloca la mitad de su volumen en agua a temperatura ambiente, en otro vaso coloca la misma cantidad de agua a temperatura elevada (se recomienda calentar hasta punto de ebullición y dejar reposar 10 min antes de usarse). Adiciona a cada vaso una gota de colorante y registre el tiempo en que ocurre la difusión del colorante.
¿En cuál experimento difundirá más rápido el colorante?, ¿por qué?
¿Es posible saber la velocidad de difusión del colorante?, ¿cómo la obtendrías?
Experimento 2. Ósmosis en una membrana biológica
Material: 1 huevo (se proporcionan dos por si la membrana se rompe),1 popote transparente, 1 barra de silicón, 1 pistola para silicón, colorante líquido, vaso de precipitados donde quepa el huevo, agua destilada y tijeras.
- Tome un huevo y retire cuidadosamente un poco del cascarón sin romper la membrana que separa el cascarón de la clara, de preferencia hacer esto en el extremo más ancho, ya que es más fácil romper el cascarón sin romper la membrana (figura 4A).
- Posteriormente, perfora el vértice opuesto de manera que sea posible introducir un popote al interior del huevo, el popote en el huevo debe estar en contacto con la clara, sin romper la yema. Sella herméticamente el espacio entre el popote y el huevo con ayuda de la pistola de silicón y vierte un poco de agua con colorante en el popote hasta ver con claridad un nivel de agua en el popote (figura 4B).
- Finalmente, coloca el huevo con la membrana expuesta hacia abajo dentro del vaso previamente llenado con agua destilada a temperatura ambiente. Es importante que la membrana esté sumergida en el agua (Figura 4C).

-
-
Figura 4. Ósmosis en una membrana biológica
4. Marca el nivel de agua al inicio y cada 10 minutos por una hora, registre sus datos y construya una gráfica (mm/minutos).
¿Qué ocurrió en este experimento? ¿Cómo se puede explicar este fenómeno?
Experimento 3. Ósmosis en una membrana sintética
Material: 10 gr de azúcar, 35 ml de agua destilada, 2 bolsas de celofán, plumones, ligas, 2 recipientes de 500 ml, 1 litro de agua de la llave y 1 jeringa de 20 ml.
- Vierte los 10 gramos de azúcar en 20 ml de agua destilada. Con ayuda de la jeringa, separa 5 ml de la solución que acabas de preparar y agrega 10 ml de agua destilada. Ahora tenemos 15 ml de solución saturada y 15 ml de una solución diluida.
- Toma dos bolsitas de celofán y etiquétalas con la leyenda “saturada” y “no saturada”, a cada una viérteles la solución de 15 ml según corresponda y amárralas con un hilo o liga para evitar derrames.
- Coloque las bolsitas en un recipiente con al menos 500 ml de agua de la llave y deja las bolsitas en el recipiente con agua al menos durante 2 h.
- Posteriormente, retira las bolsitas del agua y con la jeringa mide el volumen final de cada bolsita.
¿Hay alguna diferencia entre los volúmenes inicial y final de cada experimento?
¿En cuál de los experimentos encontraste mayor diferencia de volumen?, ¿por qué?
Experimento 4. Difusión en 2D
Material: 1 cucharada de café soluble, agua, jeringa de 20 ml, caja de Petri con grenetina, caja de Petri con agua, celular para fotografías, regla para medir el radio, Excel para realizar la gráfica.
- Prepara una solución con 1 cucharada de café soluble en 2.5 ml de agua.
- Coloca sobre la mesa una caja Petri con grenetina y una con agua a temperatura ambiente y espera a que el agua se estabilice.
- Agrega una gota de la solución concentrada de café en el centro de tu recipiente (debes agregarla con mucho cuidado para evitar mover el medio lo menos posible).
- Toma fotografías al inicio del experimento y después de cada 15 minutos, debe ser a la misma distancia y en el mismo ángulo, debes tomar al menos 5 fotografías (figura 5).
- Mide el radio del colorante en cada fotografía y realiza una gráfica, en el eje “x” coloca el valor del radio al cuadrado y en el eje “y” el tiempo. Determina la ecuación de la recta de tu gráfica y el valor de la pendiente divido entre 4 corresponderá al coeficiente de difusión del café (figura 6).
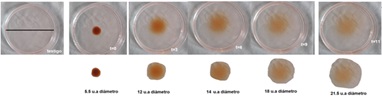
Figura 5. Ejemplo del experimento 4. Realiza distintas fotografías del café difundiendo en las cajas de Petri y mide el radio del colorante.
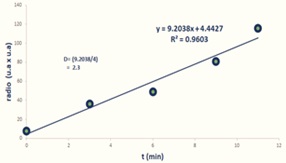
Figura 6. Gráfica resultante de la difusión del colorante. En el eje X podemos apreciar el tiempo en minutos, y en el eje Y el radio de la difusión del colorante, y se generó una pendiente que permite calcular el coeficiente de difusión del colorante.
Ahora que ya tienes tu grupo control, diseña dos experimentos modificando alguna variable (temperatura del agua, concentración del café, salinidad del medio, viscosidad del medio, etc.).
Experimento 5. Actividad en línea
Revisa el contenido del siguiente enlace sobre movimiento browniano: http://prometeo.matem.unam.mx/recursos/Licenciatura/Un100/recursos/_Un_067_MovimientoBrowniano/index.html
- Referencias
- Sharyn A. Endow, Adam P. Russell, Basics: Biophysics-A-step-by-step Introduction to concepts for students. Lesson plan: Diffusion. 2015.
- Ganong, Fisiología Médica. Barret, K. E., Barman, S. M., Boitano, S., & Brooks, H. L., 25ª edición. McGraw Hill – Lange, México, 2016.
- Hall, John E., Guyton & Hall Tratado de Fisiología Médica, 12ª edición, Elsevier – Saunders, Barcelona, 2011

Esta obra está bajo una
Licencia Creative Commons
Atribución 4.0 Internacional



Comentarios recientes