
Velocidad de conducción nerviosa y Fisiología de la contracción muscular
VELOCIDAD DE CONDUCCIÓN NERVIOSA Y FISIOLOGÍA DE LA CONTRACCIÓN MUSCULAR (CADWELL)
Objetivos de aprendizaje
- Describir las características del acoplamiento excitación-contracción en el músculo esquelético.
- Demostrar el concepto de umbral al estimular nervios motores periféricos
- Integrar la fisiología nerviosa y muscular en los estudios de velocidad de conducción nerviosa y electromiografía.
Resultados de aprendizaje
- Explica los mecanismos que participan en la transmisión neuromuscular y en la contracción muscular a través de los resultados de la práctica de laboratorio.
Glosario de términos
Ánodo: En un estimulador eléctrico, el ánodo es el polo positivo, hacía donde migran los electrones desde el cátodo (polo negativo).
Cátodo: En un estimulador eléctrico, el cátodo es el polo negativo, desde donde migran los electrones hacía el ánodo (polo positivo).
Contracción isométrica: Es el tipo de contracción en la cual se genera tensión del músculo, pero las fibras musculares se mantienen su longitud.
Contracción isotónica: Es la contracción en la que se mantiene una tensión constante en el músculo a medida que cambia de longitud.
Latencia: Tiempo que transcurre desde el inicio del estímulo hasta el inicio de la respuesta.
Unidad Motora: Unidad funcional para describir el control neuronal del proceso de contracción muscular. Cada unidad motora consiste en una motoneurona y todas las fibras musculares que inerva.
Fatiga: Incapacidad para seguir generando un nivel de fuerza o una intensidad de ejercicio determinada.
Tetania: Trastorno caracterizado por un aumento de la excitabilidad de los nervios, espasmos musculares dolorosos, temblores o contracciones musculares intermitentes, provocados por una alteración hidroelectrolítica o metabólica (hipocalcemia, hipomagnesemia, alcalosis)
- Introducción
Los estudios electrofisiológicos de electromiografía (EMG) y velocidad de conducción nerviosa (VCN), son técnicas diagnósticas de utilidad en la exploración del sistema nervioso periférico y del aparato musculoesquelético y la relación que existe entre ambas.
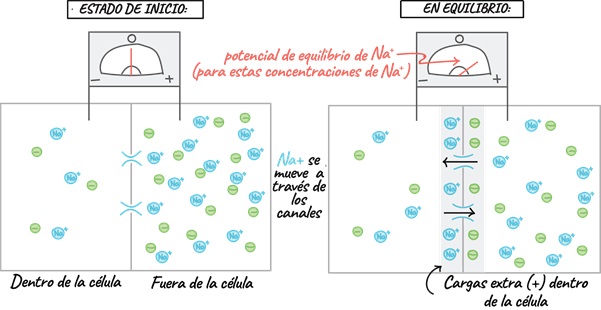
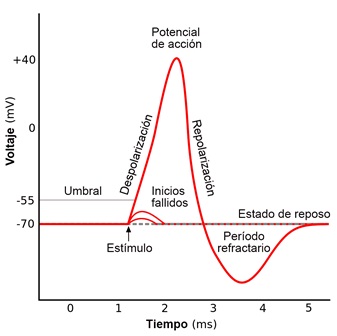
1.1 Velocidad de Conducción Nerviosa
Los estudios de conducción nerviosa son técnicas electrofisiológicas que permiten estudiar la propagación del impulso nervioso en cualquier nervio periférico que puede ser sensitivo, motor o mixto.
Son especialmente útiles para el diagnóstico de la enfermedad de nervios periféricos (neuropatía), o como seguimiento de la recuperación tras una lesión. La valoración de la velocidad de conducción nerviosa (VCN) permite comparar los nervios de las extremidades o de regiones proximales de manera bilateral.
El sistema nervioso periférico se compone de dos grandes grupos de fibras nerviosas: mielinizadas y no mielinizadas. La velocidad de conducción de una neurona depende del diámetro del axón y de la presencia de mielina que lo recubre. Cuanto mayor es el diámetro del axón, mayor es la velocidad de conducción de los potenciales de acción (clasificación de Erlanger y Gasser, tabla 1). En los humanos es posible medir la velocidad de conducción de grandes nervios, mediante el registro de los potenciales de acción, medidos extracelularmente sobre la superficie de la piel que cubre al nervio o mediante la activación del músculo que inervan. Los potenciales sensitivos se registran directamente sobre las fibras sensitivas del nervio con electrodos de superficie dispuestos sobre el trayecto del nervio.
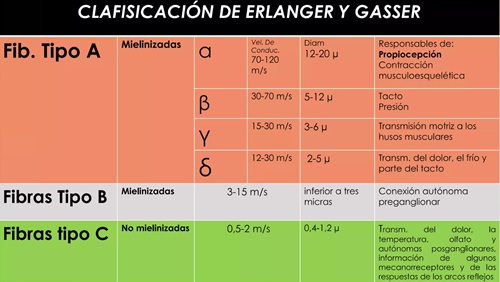
Tabla 1. Se describen los tipos de fibras nerviosas, si tienen mielina, la velocidad de conducción, el diámetro y el tipo de información que transmiten.
El potencial motor compuesto registra la actividad eléctrica generada por la contracción muscular resultante de la estimulación de un nervio con fibras motoras y se registra con electrodos de superficie sobre el músculo específico. Para el registro, normalmente se utilizan 2 electrodos de superficie, donde un electrodo es activo y el otro es referencial. Se ponen en contacto con el músculo o sobre el nervio sensitivo.
El electrodo activo tiene una localización proximal y el referencial se localiza distalmente. Estos 2 electrodos reciben el estímulo que provocamos en el nervio correspondiente. Para la estimulación, usualmente se usa un electrodo bipolar, donde un pulso de corriente se genera entre el cátodo, y el ánodo; este pulso de corriente despolariza al nervio adyacente y genera un potencial que se propaga a través de este.
Dicho estímulo debe realizarse de forma creciente hasta asegurar un estímulo máximo, es decir, un 20% superior al que evoca un potencial de amplitud máxima. En cada paciente varía la intensidad del estímulo dependiendo de varios factores, tales como, el grado de relajación del músculo, las condiciones de la piel, la presencia de edema, la cantidad de tejido adiposo, etc.
Los parámetros por estudiar son los siguientes:
– Latencia inicial: Es el tiempo transcurrido entre la estimulación y la aparición de la respuesta en un sitio de registro. Se mide en milisegundos (ms).
– Velocidad de conducción: se expresa en metros por segundo (m/s) y refleja la velocidad con la que se propaga el estímulo a través del nervio, desde la estimulación distal hasta la proximal en la conducción motora (VCM). Se expresa como resultante de la diferencia entre las latencias iniciales del potencial registrado en un sitio proximal y uno distal entre la distancia medida en milímetros (mm) que hay entre ambos estímulos.
– Características del potencial: Se evalúa la forma, amplitud, duración y área bajo la curva. Las fibras nerviosas de mayor diámetro de los nervios periféricos conducen la corriente eléctrica por encima de 45 m/s transmitiendo el impulso de forma saltatoria entre los nódulos de Ranvier hasta llegar al músculo.
1.2 Electromiografía
Se utiliza el término electromiografía (EMG) para referirse a las técnicas utilizadas en el estudio funcional del sistema neuromuscular tanto en reposo como durante una contracción. Su fundamento eléctrico se basa en el registro de potenciales bioeléctricos. Los equipos de EMG para el registro y análisis de los potenciales de acción del músculo están compuestos por electrodos de superficie o aguja que captan la señal y, una vez amplificados y filtrados, son convertidos en una señal digital. Además de la señal digital visual, los aparatos de EMG tienen altavoces para la captación acústica de la señal analógica.
Patrón de descarga de la unidad motora. La unidad motora está formada o constituida por una sola neurona motora inferior (incluyendo el cuerpo celular y sus prolongaciones) y todas las fibras musculares inervadas por las ramificaciones de su axón.
El músculo de un sujeto sano en reposo no muestra actividad eléctrica alguna en el EMG. Una contracción voluntaria media causa descargas de bajas frecuencias (1 o 2 impulsos por segundo), de una o pocas unidades motoras. El esfuerzo incrementa la fuerza muscular y se asocia con dos cambios relacionados pero separados en el patrón de descarga de la unidad motora: a) reclutamiento de las unidades previamente inactivas, y b) mayor rapidez en el disparo de las unidades ya activadas.
Un sujeto sano puede ser capaz de activar una o dos unidades motoras inicialmente. Las unidades motoras activadas son pequeñas y probablemente representan las fibras musculares de tipo I. Aquellas que son reclutadas más tarde son considerablemente más grandes y reflejan la participación de las unidades de tipo II, a esto se le conoce como “principio de tamaño” o “ley de Henneman” (figura 1). Normalmente la frecuencia de disparo es de 10 a 12 Hz.
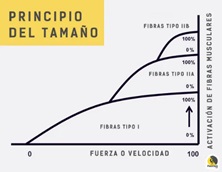
Figura 1. La Ley de Henneman o el “principio del tamaño») establece que, dado que el tamaño de las motoneuronas determina su umbral de excitación, durante la aplicación de una fuerza muscular las unidades motoras de menor tamaño serán las primeras en reclutarse, y en la medida en que el esfuerzo lo requiera, se irán reclutando más unidades motoras en un patrón estereotipado según su progresivo tamaño (Parodi, 2017).
Patrón de reclutamiento o interferencia. Cuando se incrementa la fuerza de contracción, se van sumando un mayor número de unidades motoras activas que empiezan a disparar rápidamente. La activación simultánea de muchas unidades motoras es un fenómeno llamado reclutamiento y no permite el reconocimiento de potenciales de unidades motoras individuales. Esta respuesta sumatoria usualmente se refiere como patrón de interferencia. Este patrón es una medida de la densidad o número de espigas que se generan y el promedio de amplitud de todos los potenciales de la unidad motora. La configuración y la frecuencia de disparo de cada potencial de la unidad motora, depende del número de neuronas motoras capaces de estar descargando. Al analizar el patrón de interferencia, es importante determinar no sólo cómo descargan las unidades motoras, sino también el número de unidades disparando proporcionalmente para alcanzar la fuerza muscular ejercida. El músculo a máximo esfuerzo es el resultado de la contracción de todas las unidades motoras funcionantes en el músculo en cuestión. Durante el esfuerzo máximo, las unidades motoras aisladas descargan a frecuencias en el rango de 25 a 50 impulsos por segundo. En el músculo normal aparece un trazado muy rico o interferencial que borra la línea base como consecuencia de que las unidades motoras aumentan de frecuencia de contracción y a su vez hay un mayor reclutamiento de unidades motoras.
- Actividad en la clase
2.1 Preguntas
Actividad 1. En parejas respondan las siguientes preguntas:
- ¿Es la fuerza de tu brazo derecho diferente a la de tu brazo izquierdo?
- Cuándo se sostiene un objeto de manera constante, ¿el número de unidades motoras permanece igual? ¿Son usadas las mismas unidades motoras durante todo el tiempo que se sostiene el objeto?
- Con la fatiga, la fuerza muscular disminuye, ¿qué proceso fisiológico explica la declinación en la fuerza?
- Define unidad motora.
- Define reclutamiento de unidades motoras.
- Define fatiga.
- Define EMG.
- Define dinamometría.
Actividad 2. Velocidad de conducción nerviosa y electromiografía
Sujetos y materiales para la práctica:
- 2 voluntarios para realizar un registro continuo (hombre y mujer)
- Electromiógrafo Cadwell con estimulador
- Computadora (figura 2) con software Sierra Wave
- Juego de electrodos de superficie con cables
- Gel conductor
- Algodón y alcohol
- Cinta métrica
Figura 2. Equipo Cadwell, con equipo de cómputo y estimulador
2.1 Práctica de Velocidad de conducción nerviosa
Colocación de los electrodos
Para la realización de esta práctica, siga las instrucciones del docente.
1) En la sección de ayuda del programa (ver manual operativo, o en la sección “help” del programa) se señalan claramente los puntos de estimulación y registro para la exploración de diferentes nervios. Pueden seleccionar distintos nervios, sin embargo, recomendamos el nervio mediano.
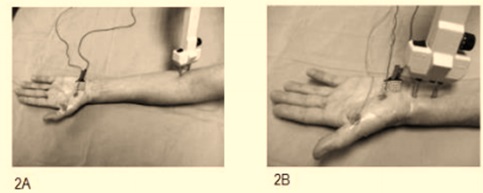
Figura 3. Ejemplo de técnica adecuada de estimulación, proximal 2A y distal 2B de nervio mediano.
2) Obtenga los registros de la actividad nerviosa a diferentes distancias de la ubicación de los electrodos de estimulación. Debe haber medido dichas distancias para poder calcular.
3) Obtenga registros de velocidad de conducción de fibras motoras y mida las velocidades de conducción.
4) Si es posible, se puede sumergir el brazo en agua fría o tibia y comparar lo obtenido con el brazo a temperatura ambiente, para que se evidencien los cambios de VNC con los cambios de temperatura.
5) Mediante el programa del equipo puede usted medir para ambos tipos de potenciales la latencia inicial, la latencia terminal, amplitud base y amplitud pico. Y en base a ellos obtener duración del potencial, área de este y al ingresar la distancia entre estímulos proximal y distal obtener también la velocidad de conducción.
6) Midan diferentes nervios y compare de manera bilateral los resultados.
7) Midan a diferentes compañeros de la clase.
8) Tabulen sus resultados y compare los registros obtenidos para los diferentes estímulos utilizados y para vías motoras y sensitivas.
9) Comparen los resultados de todos los alumnos medidos.
10) Evalúen si los valores de latencia, velocidad y amplitud se encuentran dentro de los valores de referencia (el programa muestra los valores de referencia, ver el manual operativo).
11) ¿Qué diferencias son evidentes en la morfología, amplitud, duración y latencias de los potenciales motores contra los sensoriales?
12) ¿Encuentra alguna diferencia entre los registros de un voluntario masculino y un femenino?
2.3 Desarrollo de la práctica de electromiografía
Obtención de un electromiograma de superficie (EMG) estándar:
1) En un voluntario, seleccione el músculo del que se obtendrá el registro, bíceps braquial, por ejemplo. La superficie deberá estar descubierta, la región deberá estar libre de ropa, pulseras, relojes, etc.
2) Limpie con algodón y alcohol la región en donde se colocarán los electrodos de superficie.
3) Coloque un electrodo cerca de la inserción proximal del músculo en estudio y otro cerca de la inserción distal, de manera que queden paralelos a las fibras del músculo (esta ubicación se puede variar dependiendo de la longitud del músculo a explorar). Para la colocación adecuada de los electrodos, puede en la ventana del programa “ayuda”, seleccione el “EMG”, se abrirá una lista de los músculos que puede explorar y donde debería colocar los electrodos (figura 4).
4) Coloque un tercer electrodo en cualquier otra parte del cuerpo, alejado del sitio donde se encuentren los electrodos de registro.
5) Una vez activado el sistema de registro se puede obtener un registro inicial como el que se muestra a continuación:
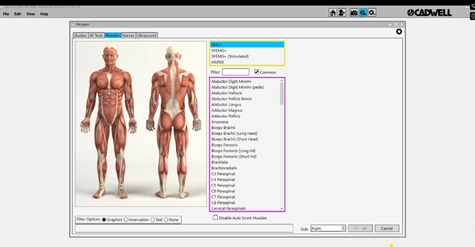
Figura 4. Manual de referencias para la colocación de los electrodos.
Obtención del EMG en diversas condiciones
En un voluntario, comience el registro de la actividad muscular (figura 5) y realicen las siguientes maniobras:
1) Contracción isotónica: Coloque los electrodos en los extremos del bíceps braquial y pida al paciente que levante un peso de valor conocido, registre el EMG de dicho movimiento.
2) Contracción isométrica: Coloque los electrodos en los extremos del bíceps braquial y pida al paciente que mantenga levantado el peso, manteniendo un ángulo de 45° entre el brazo y el antebrazo, registre el EMG de este fenómeno.
3) Reclutamiento de unidades motoras: Con la misma preparación se pedirá al paciente que levante un peso cuyo valor se irá incrementando paulatinamente. Registre el EMG durante toda la operación.
4) Fatiga de contracción: Con la misma preparación pida al voluntario que realice flexiones y extensiones del antebrazo sobre el brazo hasta que la amplitud y duración del fenómeno eléctrico que registra se reduzca en al menos un 50%.
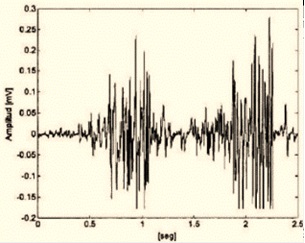
Figura 5. Electromiograma típico, en las abscisas se encuentra el tiempo (ms), en las ordenadas el voltaje (mV)
Resultados Práctica EMG
El registro que usted obtuvo se puede analizar de varias maneras. La más sencilla es medir la duración y la amplitud (voltaje) de la descarga eléctrica que se produce cuando se contrae el músculo contra una carga cero o en el reposo. Es decir, cuando no se le aplica ninguna resistencia, y se compara con la magnitud y duración de esta descarga cuando se aplican resistencias sucesivas. Estos valores, de voltaje y duración de cada contracción, se pueden representar en una gráfica que relacione el peso levantado respecto a las características eléctricas de la contracción.
Para finalizar, respondan:
1) ¿Puede usted medir la intensidad de la contracción en los registros obtenidos?
2) De ser así, ¿de qué magnitud es? Si la respuesta es negativa ¿cuál es la razón? ¿Qué otro tipo de análisis se puede hacer?
3) ¿Cómo se modifica el EMG al aumentar la carga?
4) ¿Qué cambios ocurren cuando se fatiga el músculo?
5) ¿El EMG cambia según el músculo?
6) ¿Si cambia la posición de los electrodos también lo hace la forma del EMG?
- Bibliografía
- Berne & Levy. Fisiología. 7ª Edición. Madrid: Elsevier. 2018.
- Fisiología Humana. Editorial Panamericana, 2018.
- Fernández, J. M., Acevedo, R. C., y Tabernig, C. B. (2007). Influencia de la fatiga muscular en la señal electromiográfica de músculos estimulados eléctricamente. Revista EIA, (7), 111-119. ¿Recuperado de http://www.scielo.org.co/ scielo.php?script=sci_arttext&pid=S1794-12372007000100010
- Hall, J.E. (2016). Guyton y Hall. Tratado de fisiología médica. Barcelona, España: Elsevier.
- Massó, N., Rey, F., Romero, D., Gual, G., Costa, L., & Germán, A. (2010). Aplicaciones de la electromiografía de superficie en el deporte. Apunts Sports Medicine, 45(166), 127-136. Disponible en: https://raco.cat/index.php/Apunts/article/view/196617/298837
- Moreno Quinchanegua, J. E. (2018). LA FATIGA, TIPOS CAUSAS Y EFECTOS. Revista Digital: Actividad Física Y deporte, 3(2). https://doi.org/10.31910/rdafd.v3.n2.2017.376
- Parodi Feye, A. S. (2017). Análisis crítico de la Ley de Henneman. Educación Física Y Ciencia, 19(2), e032. https://doi.org/10.24215/23142561e032
- Robergs, R. A., Ghiasvand, F., y Parker, D. (2004). Biochemistry of exercise-induced metabolic acidosis. American journal of physiology. Regulatory, integrative and comparative physiology, 287(3), R502–R516. doi: 10.1152 / ajpregu.00114.2004

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional
VELOCIDAD DE CONDUCCIÓN NERVIOSA Y FISIOLOGÍA DE LA CONTRACCIÓN MUSCULAR (SOFTWARE Y HARDWARE LIBRE)
Objetivos de aprendizaje
Antes de esta práctica, los estudiantes deberían ser capaces de:
-
-
- identificar y describir la función de diferentes componentes y compartimentos celulares (ej. membrana plasmática, retículo endoplasmático)
- comprender los conceptos básicos de la generación de potenciales de acción, ej. en la unión neuromuscular
- explicar conceptos básicos de física, como función de palanca, trabajo y fuerza
Durante esta práctica, los estudiantes:
- aprenderán cómo registrar electromiogramas (EMG) de músculos esqueléticos
- observarán y registrarán cambios en el EMG cuando los músculos se contraen y relajan
- investigarán los efectos de cambiar la velocidad y fuerza de contracción en la EMG
- compararán y contrastarán registros de tres sistemas de palanca diferentes en el cuerpo
Después de esta práctica, los estudiantes deberían ser capaces de:
- explicar la relación entre la actividad eléctrica de las células musculares y la contracción
- comprender los conceptos básicos del registro EMG
- diseñar experimentos adicionales para investigar la actividad de diferentes músculos.
-
Glosario de términos
Ánodo: En un estimulador eléctrico, el ánodo es el polo positivo, hacía donde migran los electrones desde el cátodo (polo negativo).
Cátodo: En un estimulador eléctrico, el cátodo es el polo negativo, desde donde migran los electrones hacía el ánodo (polo positivo).
Contracción isométrica: Es el tipo de contracción en la cual se genera tensión del músculo, pero las fibras musculares se mantienen su longitud.
Contracción isotónica: Es la contracción en la que se mantiene una tensión constante en el músculo a medida que cambia de longitud.
Latencia: Tiempo que transcurre desde el inicio del estímulo hasta el inicio de la respuesta.
Unidad Motora: Unidad funcional para describir el control neuronal del proceso de contracción muscular. Cada unidad motora consiste en una motoneurona y todas las fibras musculares que inerva.
Fatiga: Incapacidad para seguir generando un nivel de fuerza o una intensidad de ejercicio determinada.
Tetania: Trastorno caracterizado por un aumento de la excitabilidad de los nervios, espasmos musculares dolorosos, temblores o contracciones musculares intermitentes, provocados por una alteración hidroelectrolítica o metabólica (hipocalcemia, hipomagnesemia, alcalosis).
- Resumen
En esta práctica experimental, los estudiantes aprenden sobre la estructura y función muscular, y cómo los músculos proporcionan la fuerza para mover diferentes partes del cuerpo humano. Los estudiantes aprenden a realizar registros de sus músculos esqueléticos usando electromiografía, registrando músculos de los tres tipos de sistemas de palanca. Esta práctica está diseñada para ayudar a los estudiantes a comprender la biomecánica del sistema musculoesquelético, y cómo el movimiento se relaciona con la actividad eléctrica en células musculares. La duración de la práctica puede ser tan corta como 30 minutos o hasta 2 horas, dependiendo del número de músculos registrados y la complejidad de las diferentes actividades exploradas.
- Introducción
Los músculos esqueléticos proporcionan fuerza para mover ‘palancas’ en el cuerpo humano
Los movimientos del sistema musculoesquelético humano se logran mediante conjuntos de huesos, articulaciones y músculos que trabajan juntos de forma muy similar a los sistemas de palanca [Open Learning Initiative, 2016, Guyton and Hall, 2016, Betts et al., 2013]. Una palanca está compuesta por una barra o varilla rígida (el brazo de palanca) que gira alrededor de un punto fijo (el fulcro) y puede mover una carga o superar una resistencia cuando se aplica una fuerza. Las palancas se agrupan en tres clases, dependiendo de la colocación relativa del fulcro, la fuerza aplicada y la carga o resistencia (Figura 1). Las palancas de clase 1 tienen un fulcro central con la fuerza aplicada en un lado y la carga en el otro (ej., subibaja). Para las palancas de clase 2, la carga es central y la fuerza y el fulcro están en lados opuestos (ej., una carretilla). Para las palancas de clase 3, la fuerza se aplica centralmente y el fulcro y la carga están en extremos opuestos del brazo (ej. un par de pinzas es un par de palancas de tercera clase).

Figura 1 The three classes of levers — class 1 (a), class 2 (b), and class 3 (c) — with corresponding examples in the human body. Shown are the relative positions of the fulcrum (F), resistance (R), and effort (E) or force applied in each case. Image credit: “Lever Systems of the Human Body” by Daniel Donnelly, CC BY 4.0, Retrieved from https://www.flickr.com/photos/187096960@N06/51172431376
En el cuerpo humano, los huesos actúan como brazos de palanca y las articulaciones como fulcros. La fuerza para superar una resistencia o levantar una carga es proporcionada por la contracción de músculos esqueléticos, que están unidos a los huesos por tendones [Open Learning Initiative, 2016, Guyton and Hall, 2016, Betts et al., 2013]. Las tres clases de palancas sí se encuentran en el cuerpo humano, aunque algunas son más comunes que otras. Las palancas de clase 1 son raras, pero existen algunos ejemplos, incluyendo el sistema hueso-articulación responsable de la flexión y extensión de la cabeza (bajar o levantar la cabeza, respectivamente; Figura 1a). En este caso, el fulcro es la articulación entre el cráneo y la primera vértebra cervical. La carga, o resistencia, es el peso de la cabeza misma. La fuerza para levantar la cabeza es aplicada por la contracción de músculos esqueléticos en el cuello y la parte superior de la espalda, incluyendo el esplenio de la cabeza y semiespinal de la cabeza [Betts et al., 2013]. El brazo de palanca en este caso no es tan obvio como en los sistemas de huesos largos, pero es el cráneo mismo. Se puede imaginar una línea que va diagonalmente desde los músculos del cuello en la izquierda, hacia arriba a través de la articulación cervical, y termina en un punto del cráneo arriba de la cuenca del ojo.
Cuando una persona se pone de puntillas, podemos observar un ejemplo de palanca de clase 2 en el cuerpo humano (Figura 1b). El pie es el brazo de palanca, las articulaciones entre los huesos del pie y los de los dedos —las articulaciones metatarsofalángicas [Betts et al., 2013]— actúan como punto de apoyo, y la carga es el peso corporal de la persona [Open Learning Initiative, 2016]. La fuerza necesaria para levantar el cuerpo se obtiene mediante la contracción de los músculos gastrocnemio (comúnmente llamados gemelos) y sóleo de la pantorrilla [Betts et al., 2013].
Las palancas de clase 3 son el tipo más observado en el cuerpo humano [Open Learning Initiative, 2016]. El ejemplo clásico es el complejo formado por el bíceps braquial, el codo y el antebrazo (Figura 1c). En este ejemplo, el antebrazo es el brazo de palanca, la articulación del codo es el fulcro, y la fuerza requerida para mover el brazo hacia arriba (flexionar) o levantar una carga es proporcionada por el bíceps.
Estructura del músculo esquelético
Para entender cómo se contraen los músculos, primero debemos conocer su estructura. Los músculos esqueléticos están compuestos por múltiples fascículos, que son haces de muchas fibras musculares más pequeñas rodeadas por una capa de tejido conectivo (Figura 2). Cada fibra muscular está compuesta a su vez por muchas miofibrillas más pequeñas, que contienen la maquinaria molecular que permite la contracción [Guyton and Hall, 2016, Betts et al., 2013]. En muchos músculos esqueléticos, los fascículos se disponen en paralelo, extendiéndose a lo largo de la longitud del músculo. Otros músculos muestran un arreglo circular de fascículos. Algunos músculos tienen fascículos que se encuentran en un punto de inserción (convergente), mientras que otros se extienden desde un tendón central (penniforme). El arreglo de los fascículos afecta la dirección y el ángulo en el que las fibras pueden tirar, y también afecta la generación de fuerza en el músculo [Betts et al., 2013].

Figura 2 Estructura muscular y niveles de organización. La imagen superior muestra los fascículos musculares. La imagen del medio amplía un fascículo para mostrar las fibras musculares. La imagen inferior muestra el detalle en una fibra muscular para evidenciar las miofibrillas. Imagen: OpenStax, CC BY 4.0 https://openstax.org/books/anatomy-and-physiology/pages/10-2-skeletal-muscle
Rodeando a la fibra muscular está la membrana plasmática, o sarcolema. En el sarcolema están incrustadas proteínas transmembrana, como canales iónicos que median corrientes y permiten la generación de potenciales de acción (PA) musculares. Estos PA se propagan a través de invaginaciones en el sarcolema, conocidas como túbulos transversos (T) (Figura 3). Posicionado justo al lado de los túbulos T está el retículo sarcoplasmático, el equivalente del retículo endoplasmático en el músculo. Aquí, canales específicos responden a los cambios en voltaje generados por los PA que se propagan para iniciar eventos intracelulares que activan la maquinaria contráctil [Guyton and Hall, 2016, Betts et al., 2013].

Figura 3 Las invaginaciones en el sarcolema forman los túbulos T, que corren por las miofibrillas y están flanqueados por retículo sarcoplasmático (RS) en ambos lados. Derecha: Cerca del RS, las proteínas están organizadas en sarcómeros, la unidad contráctil del músculo. Imagen: Adaptado de imágenes de OpenStax, CC BY 4.0 https://openstax.org/books/anatomy-and-physiology/pages/10-2-skeletal-muscle.
La unidad contráctil funcional del músculo esquelético se conoce como sarcómero. En los músculos esqueléticos, los sarcómeros están organizados en serie a lo largo de la longitud de las miofibrillas. Los cambios regulares y repetidos en la densidad de proteínas particulares en los sarcómeros es lo que da a los músculos esqueléticos su apariencia rayada, o estriada, microscópicamente [Rall, 2018].
Modelo de filamentos deslizantes y relación longitud-tensión
Los sarcómeros contienen diversas proteínas, como la titina, que actúa como un «resorte molecular» y es importante para establecer la elasticidad y la tensión pasiva en los músculos [Granzier and Labeit, 2006]. Sin embargo, la base de la contracción reside en la interacción entre los filamentos de actina (finos) y los filamentos de miosina (gruesos) [Guyton and Hall, 2016, Betts et al., 2013]. Estos filamentos se disponen en paralelo, con áreas de superposición. La miosina puede unirse a la actina a través de sitios de unión en la región de la cabeza de miosina, formando lo que se denomina un puente cruzado. Cuando la cabeza se mueve, los filamentos se deslizan uno sobre el otro, aumentando el área de superposición y acortando el sarcómero (Figura 4).

Figura 4 Modelo de filamento deslizante de contracción muscular. La imagen superior muestra el sarcómero en el músculo relajado. Los filamentos presentan zonas de superposición, pero no están activamente conectados. La imagen inferior muestra el sarcómero en el músculo contraído. Las cabezas de miosina se unen a los filamentos de actina, desplazándose hacia la línea M, y se deslizan para acortar el sarcómero. Imagen: Richfield, David (2014). “Galería médica de David Richfield”. WikiJournal of Medicine 1 (2). DOI:10.15347/wjm/2014.009. ISSN 2002-4436.
Cuando esto ocurre en múltiples sarcómeros a lo largo de la miofibrilla, esta se acorta. Si el mismo efecto ocurre en muchas miofibrillas dentro de muchos fascículos, todo el músculo se acorta y produce una contracción. Esta descripción de la interacción entre los filamentos de miosina y actina se denomina modelo de filamento deslizante de contracción [Guyton and Hall, 2016, Betts et al., 2013]. Los pasos mediante los cuales los filamentos de miosina y actina se enganchan, deslizan, separan y luego se restablecen se denominan en conjunto ciclo de puentes cruzados (tratado con más detalle a continuación).
Existe un nivel intermedio óptimo de superposición de filamentos que produce una tensión máxima en el músculo [Guyton and Hall, 2016, Betts et al., 2013]. Muy poca superposición y los filamentos no pueden unirse ni interactuar; demasiada superposición y no hay capacidad para que se deslicen adicionalmente. La relación entre la superposición de filamentos (es decir, la longitud del sarcómero) y la tensión muscular se llama relación longitud-tensión, y se muestra en Figura 5.

Figura 5 Relación longitud-tensión en músculo. Se produce una tensión máxima cuando los filamentos de actina y miosina tienen una superposición óptima para deslizarse, es decir, alrededor del 80-100% de la longitud de reposo del sarcómero. Imagen: OpenStax, CC BY, https://openstax.org/books/anatomy-and-physiology/pages
/10-4-nervous-system-control-of-muscle-tension
Acoplamiento excitación-contracción y ciclo de puentes cruzados
¿Cómo es que un PA generado en la unión neuromuscular (UNM) (la generación del PA en la UNM no se aborda aquí, pero puede revisarse en el Cap. 7 de Guyton & Hall) conduce al ciclo de puentes cruzados dentro de los sarcómeros? En otras palabras, ¿cómo se acopla la excitación a la contracción? El PA se propaga desde la UNM a través de los túbulos T para alcanzar el interior de las miofibrillas [Guyton and Hall, 2016, Betts et al., 2013]. Dentro del túbulo T, el cambio de voltaje activa un canal de calcio dependiente de voltaje conocido como Cav1.1, o receptor de dihidropiridina (DHPR) [Schneider and Hernández-Ochoa, 2012]. El DHPR está mecánicamente vinculado al receptor de rianodina (RyR) incrustado en la membrana del retículo sarcoplásmico (RS). La activación del DHPR provoca un cambio conformacional que, a su vez, activa al RyR, abriendo el canal y permitiendo que el calcio salga del RS a favor de su gradiente electroquímico. Este aumento de calcio intracelular libre, a su vez, permite la formación de puentes cruzados. Si no hay calcio presente, no se pueden formar los puentes cruzados porque un complejo de proteínas de tropomiosina y troponina bloquea el sitio de unión a la miosina en los filamentos de actina. Cuando el calcio se une a la troponina, produce un cambio conformacional que desplaza a la tropomiosina y permite la unión entre miosina y actina. Una vez que están unidos, los filamentos pueden deslizarse [Betts et al., 2013, Schneider and Hernández-Ochoa, 2012].
Para continuar el ciclo, los filamentos de miosina y actina también deben poder separarse y restablecer su posición. Este proceso requiere energía en forma de ATP [Guyton and Hall, 2016, Betts et al., 2013]. Cuando la miosina se une al ATP, se desprende de la actina. Posteriormente, el ATP se hidroliza y la energía liberada se utiliza para mover la cabeza de miosina de regreso a la posición “cargada”, lista para unirse nuevamente a la actina. El ADP y un fosfato inorgánico permanecen unidos a la cabeza de miosina. Luego, la miosina se une a la actina y libera el fosfato inorgánico. A continuación, la cabeza de miosina libera el ADP y se mueve hacia el interior en lo que se llama golpe de fuerza, lo que provoca que los filamentos de actina se deslicen hacia la línea media y acorten el sarcómero. El ciclo de puentes cruzados continúa mientras haya suficiente ATP y calcio presentes. El músculo se relaja cuando el calcio es bombeado de nuevo al RS y ya no está disponible, lo que permite que la tropomiosina vuelva a bloquear el sitio de unión actina-miosina [Guyton and Hall, 2016, Betts et al., 2013].
Pregunta de estudio: ¿En qué se diferencian los detalles moleculares del acoplamiento excitación-contracción en el músculo cardíaco y el músculo liso, en comparación con el músculo esquelético?
Respuestas de las fibras musculares, sumación y reclutamiento
La respuesta de un músculo a la estimulación depende del momento y la intensidad del estímulo [Betts et al., 2013, Schneider and Hernández-Ochoa, 2012]. Si solo ocurre un estímulo breve, la fibra muscular responderá con un único PA y se producirá sólo una contracción breve (de decenas a cientos de milisegundos). Debido a que los eventos intracelulares necesarios para producir una contracción tardan más que los que generan un PA, puede llegar otro PA antes de que la fibra muscular se haya relajado por completo. Si esto ocurre, la segunda respuesta se sumará a la tensión ya presente en el músculo, en un proceso llamado sumación. Para lograr una contracción sostenida de la fibra muscular y generar una tensión lo suficientemente grande como para realizar trabajo, se requiere la sumación de múltiples eventos estimulantes [Guyton and Hall, 2016, Schneider and Hernández-Ochoa, 2012].
Además de la sumación dentro de fibras musculares individuales, se activan múltiples fibras para lograr la contracción del músculo completo. Una neurona motora y todas las fibras musculares a las que envía señales (inerva) dentro de un músculo se llama unidad motora. Las unidades motoras pueden variar en tamaño, algunas neuronas motoras inervan pocas fibras (unidad pequeña) y otras inervan muchas (unidad grande). Los músculos pueden variar la fuerza que generan dependiendo del número y tipo de unidades motoras que se reclutan [Betts et al., 2013].

Figura 6 Respuestas musculares. Izquierda: Miograma que muestra la tensión desarrollada durante una contracción breve de una fibra muscular producida por un solo estímulo breve. Derecha: Estímulos múltiples aplicados en rápida sucesión producen sumación y aumento de la tensión. Si la frecuencia de estimulación es lo suficientemente alta, las respuestas se fusionan en un tétanos. Se logra una tensión máxima y una contracción continua. Imagen: Open Stax, CC BY, https://openstax.org/books/anatomy-and-physiology/pages/10-4-nervous-system-control-of-muscle-tension
Medición de la actividad eléctrica de los músculos esqueléticos – electromiograma
Para registrar la actividad eléctrica de los músculos se utiliza una técnica llamada electromiografía, y las grabaciones obtenidas se denominan electromiogramas [Cavalcanti Garcia and Vieira, 2011]. (Usamos ‘EMG’ para referirnos a la técnica y/o al registro dependiendo del contexto.) El registro se puede realizar de forma invasiva, insertando electrodos en el músculo de interés, o de forma no invasiva, utilizando electrodos de superficie, colocados sobre la piel que recubre el músculo. Insertar los electrodos permite obtener grabaciones de EMG más limpias, donde puede distinguirse la actividad de unidades motoras individuales. Sin embargo, la inserción puede ser dolorosa y requiere condiciones estériles para evitar infecciones, por lo que no es ideal para contextos educativos. En cambio, los electrodos de superficie pueden colocarse y retirarse fácilmente sin causar daño. Las limitaciones de este tipo de registro extracelular incluyen que solo puede medirse la actividad de músculos superficiales y que no siempre es posible distinguir unidades motoras individuales [Cavalcanti Garcia and Vieira, 2011]. Estas limitaciones no son prohibitivas y suelen compensarse con los beneficios de la no invasividad, aunque deben tenerse en cuenta al decidir dónde colocar los electrodos y cómo analizar los datos.
Una de las configuraciones de registro más comunes se denomina EMG bipolar, o EMG diferencial simple [Cavalcanti Garcia and Vieira, 2011]. Para realizarla se colocan dos electrodos de superficie sobre la piel, encima del músculo de interés, separados solo por unos pocos centímetros Figura 7. Al restar las señales registradas en ambos puntos y amplificar la diferencia, se excluyen en gran medida las señales comunes que podrían provenir de otros músculos fuera del área de registro, registrándose principalmente cambios locales en la actividad eléctrica. Esta configuración reduce la interferencia entre músculos [Cavalcanti Garcia and Vieira, 2011].

Figura 7 Configuración de registro EMG bipolar. Por simplicidad, no se muestran todos los componentes del cuerpo ni del sistema de registro. Crédito de la imagen: Erin C. McKiernan, CC BY, basado en una figura de [Cavalcanti Garcia and Vieira, 2011].
Los EMG bipolares de superficie pueden informarnos sobre varios aspectos de la actividad muscular [Cavalcanti Garcia and Vieira, 2011]. Uno de ellos es el momento en que se activa o relaja el músculo. La mayoría de los músculos muestran muy poca actividad en reposo. Cuando se activan, se observa un aumento notable en la aparición de impulsos eléctricos, como se muestra en la Figura 7, lado derecho. Cuando el músculo se relaja, estos impulsos desaparecen y solo se registra el ruido de base. También podemos estimar, hasta cierto punto, la fuerza o el esfuerzo ejercido durante una contracción. A medida que el sujeto aumenta la fuerza de la contracción, se observa un aumento tanto en la frecuencia de los impulsos eléctricos como en la amplitud de la señal. Estos cambios se deben a dos factores: (1) una mayor frecuencia de disparo en las unidades motoras ya activas, y (2) el reclutamiento de unidades motoras adicionales. Recuerda que se está registrando la actividad de múltiples unidades motoras. Con una mayor fuerza de contracción, se reclutan más unidades motoras que comienzan a activarse, y su actividad se suma, contribuyendo al aumento de frecuencia y amplitud.
- Actividades en clase
Actividad 1. Preguntas de estudio
- ¿Dónde deberás colocar los electrodos para registrar EMGs de un sistema de palanca de clase 1, clase 2 o clase 3?
- ¿Podrás registrar desde cualquier músculo que desees en cada sistema de palanca? ¿Por qué sí o por qué no?
- ¿Cómo sabrás si colocaste correctamente los electrodos? ¿Qué podrías hacer para verificarlo?
Actividad 2. Protocolo experimental para electromiografía
Equipo y materiales
- Muscle SpikerBox (Backyard Brains)
- Batería de 9V para alimentar el SpikerBox
- Electrodos de superficie redondos (cualquier proveedor de suministros médicos)
- Cable con pinzas cocodrilo para conectar electrodos al SpikerBox (Backyard Brains)
- Cable para conectar SpikerBox a una computadora, tableta o teléfono (Backyard Brains)
- Computadora, tableta o teléfono con el software gratuito Spike Recorder instalado
- Adaptador para teléfono o tableta, de aux 3.5mm a USB-C (si no hay puerto aux en los dispositivos; cualquier proveedor)
- Alcohol y hisopos de algodón para quitar electrodos después del registro (opcional)
Otras indicaciones: Usar ropa holgada para permitir la colocación de electrodos
Antes de comenzar, asegúrate de tener todo el equipo necesario y de haber instalado el software Spike Recorder en tu computadora o teléfono. Los siguientes pasos te guiarán para configurar el equipo y realizar las grabaciones.
Configura las grabaciones de EMG
La Muscle SpikerBox de Backyard Brains viene completamente ensamblada y casi lista para grabar. Solo tienes que conectar la batería, los cables y los electrodos.
- Conecta la batería de 9V a sus terminales en la Muscle SpikerBox
- Conecta el cable negro/azul o verde al puerto correspondiente en la Muscle SpikerBox para computadora, tableta o teléfono; ten en cuenta que el cable para smartphone es direccional y está etiquetado, así que asegúrate de insertar el extremo correcto en el dispositivo
- Conecta el otro extremo del cable negro/azul o verde a tu computadora, tableta o teléfono
- Conecta el cable naranja a su puerto correspondiente en la Muscle SpikerBox
- Coloca los electrodos de superficie sobre el músculo de interés, separados por solo unos centímetros y orientados en paralelo a las fibras musculares; recuerda que para registrar cada tipo de palanca, deberás cambiar la colocación de los electrodos entre experimentos
- Palanca de clase 1 – músculo de interés: splenius capitis
- Palanca de clase 2 – músculo de interés: gastrocnemio
- Palanca de clase 3 – músculo de interés: bíceps braquial
- Conecta cada una de las pinzas tipo cocodrilo rojas del extremo del cable naranja a uno de los electrodos de superficie; asegúrate de que las partes metálicas no se toquen entre sí y trata de evitar que los cables se enreden
- Sostén la pinza negra tipo cocodrilo (referencia) en tu mano, o conéctala a otro electrodo de superficie en el dorso de la mano o alguna otra zona alejada del sitio de registro, por ejemplo sobre un hueso
- Para mejorar la señal de EMG, puede limpiarse con alcohol la zona donde se colocarán los electrodos; espera a que se seque completamente antes de colocarlos
- Puede usarse gel para electrodos para mejorar la conducción, aunque no suele ser necesario, especialmente si los electrodos tienen un adhesivo fuerte que asegure buen contacto con la piel; la mayoría de los electrodos estándar tiene un buen pegamento y se recomienda no usar gel
- Para evitar artefactos de ruido, asegúrate de que ninguna prenda toque los electrodos o esté rozando los cables durante la grabación

Figura 8 Izquierda: Configuración del EMG con electrodos conectados a la Muscle SpikerBox. (La conexión con computadora o teléfono no se muestra.) Imagen: Backyard Brains, CC BY NC. Fuente: https://backyardbrains.com/products/muscle-spikerbox
Prueba las grabaciones de EMG
- Enciende la Muscle SpikerBox girando la rueda negra en el lateral; debería encenderse una luz verde. Nota: los electrodos deben estar conectados antes de encender el dispositivo y deben desconectarse solo después de apagarlo para evitar un molesto ruido.
- Abre el software Spiker Recorder y explora los controles y configuraciones; para más información sobre el uso del software, consulta [Lazarevic, 2020]
- Chasquea los dedos cerca del dispositivo de grabación; si ves un artefacto correspondiente en la pantalla, significa que solo estás grabando audio. Para comenzar a registrar actividad muscular, ajusta la configuración presionando el botón ‘Config’ y conectate al puerto indicado.
- Pídele al sujeto experimental que contraiga y relaje brevemente el músculo de interés, y verifica que se observan potenciales eléctricos durante la contracción.
- Revisa la relación señal-ruido; si la señal es muy débil, ajusta la ganancia o amplificación girando la rueda hacia la derecha.
- Intenta guardar una grabación en tu computadora o teléfono; el formato será .wav y usualmente se guarda en una carpeta de música u otra donde se almacenan archivos de audio. (Nota: Algunos dispositivos no permiten la grabación, funciona mejor con iPhone, algunos de Android con sistema operativo antiguo, algunas computadoras como Mac)

Figura 9 Interfaz del software de grabación. Imagen: Backyard Brains, CC BY NC. https://help.backyardbrains.com/support/solutions/articles/43000607420-spike-recorder-for-pc-mac-linux
Recolectar datos de EMG
- Asegúrate de que el dispositivo esté listo para grabar y que la persona voluntaria esté en posición de reposo.
- Antes de comenzar la grabación, pídele a la persona voluntaria que piense en el tipo de movimiento que debe hacer para activar el músculo de interés. Por ejemplo, para el gastrocnemio, esto implica pararse de puntillas; para el splenius capitis, levantar la cabeza.
- Cuando la persona esté lista, presiona ‘record’ en la interfaz del Spike Recorder
- Indícale que permanezca relajada durante unos segundos después de comenzar la grabación, luego que contraiga el músculo de interés por unos segundos, y que después lo relaje nuevamente por unos segundos.
- Pídele que repita la secuencia anterior al menos 3 veces para poder obtener diferentes mediciones.
- Termina la grabación y guarda los datos en tu computadora, tableta o teléfono; las grabaciones deben guardarse y exportarse en formato .wav para su análisis.
- Inicia una nueva grabación para examinar los efectos de la fuerza de contracción en la señal EMG.
- Indica a la persona que realice una primera contracción con muy poca fuerza, luego haga una pausa; después una segunda contracción con mayor fuerza, pausa nuevamente; y finalmente una tercera contracción con fuerza máxima.
- Termina las grabaciones y guarda los datos en tu computadora o teléfono.
- Inicia una nueva grabación para examinar los efectos de distintas actividades físicas y de la fatiga sobre la señal EMG.
- Indica a la persona que contraiga el músculo de interés y mantenga la contracción el mayor tiempo posible. ¿Cuánto tiempo puede mantenerla? ¿Qué ocurre al comenzar a fatigarse? ¿Qué diferencias observas entre fuerza mínima y fuerza máxima?
- Termina la grabación y guarda los datos en tu computadora, tableta o teléfono.
- Repite lo anterior para cada músculo correspondiente a los tres tipos de sistema de palancas; las personas deben descansar unos minutos entre grabaciones.
- Recuerda etiquetar tus datos para saber a qué persona, músculo y tipo de experimento pertenece cada grabación.
- Si no funciona la grabación en sus dispositivos, se puede grabar la pantalla (solo que no se puede realizar análisis cuantitativo después); si no les interesa analizar los datos después se puede simplemente registrar y hacer observaciones y conclusiones cualitativos durante la práctica.
- Realiza contracciones isotónicas, isométricas y con dinamómetro para poder evaluar si la señal se relaciona con la actividad que observar en el registro como se sugiere a continuación.
Actividades para evaluar la señal de EMG
- Registrar el músculo masetero al masticar chicle u otros alimentos. También intente abrir y cerrar pasivamente la boca y sonreír para comparar la activación del músculo con diferentes movimientos. Recuerde colocar los electrodos de registro en paralelo a las fibras musculares, es decir, casi verticales o en una ligera diagonal según la posición del músculo masetero que se siente al apretar la mandíbula. El electrodo de tierra/referencia se coloca detrás de la oreja, sobre el proceso mastoideo. Se recomienda utilizar electrodos de ECG pediátricos para esta grabación, ya que son más pequeños y mejores para registrar los músculos faciales que los electrodos estándar más grandes.

- Registrar el segundo músculo interóseo dorsal durante la abducción del dedo índice. Intente también levantar el dedo o moverlo lateralmente de forma pasiva con la ayuda de otro dedo para comparar la actividad muscular. Coloque los dos electrodos de registro en el espacio entre el segundo y el tercer dígito. El electrodo de tierra/referencia se coloca en el dorso de la mano. Los músculos más pequeños de la mano requieren electrodos más pequeños, como electrodos de lengüeta cuadrada que se pueden cortar en tiras o cuadrados, conservando la lengüeta donde se fijan las pinzas de cocodrilo.

- Registrar los bíceps de dos voluntarios y compárelos durante diferentes actividades, como lucha de brazos o levantamiento de pesas (ej., mochilas cargadas de libros). Esto requerirá dos dispositivos de grabación o un dispositivo con dos canales. Pregunte a los estudiantes cómo podrían comparar los registros, dado que dos sujetos pueden tener una actividad de base y una amplitud de registro muy diferentes.

- Registrar los bíceps de dos voluntarios y compárelos mientras se sostiene un dinamómetro y observe el cambio en la señal. Durante esta actividad le pediremos al voluntario que apriete con fuerza el dinamómetro Jamar que se muestra aquí y registraremos la fuerza que está realizando, para relacionarlo con la amplitud de la señal eléctrica de EMG.

Referencias
[1] Open Learning Initiative. Levers and Movement. Carnegie Mellon University, 2016. URL: https://oli.cmu.edu/jcourse/workbook/activity/page?context=df3c7cac0a0001dc63b5a789a1529c51.
[2] A.C. Guyton and J.E. Hall. Textbook of Medical Physiology. Elsevier Saunders, Philadelphia, Pennsylvania, USA, 13 edition, 2016.
[3] J.G. Betts, K.A. Young, J.A. Wise, E. Johnson, B. Poe, D.H. Kruse, O. Korol, J.E. Johnson, M. Womble, and P. DeSaix. Interactions of Skeletal Muscles, Their Fascicle Arrangement, and Their Lever Systems. OpenStax, 2013. URL: https://openstax.org/books/anatomy-and-physiology/pages/11-3-axial-muscles-of-the-head-neck-and-back.
[4] J.G. Betts, K.A. Young, J.A. Wise, E. Johnson, B. Poe, D.H. Kruse, O. Korol, J.E. Johnson, M. Womble, and P. DeSaix. Axial Muscles of the Head, Neck, and Back. OpenStax, 2013. URL: https://openstax.org/books/anatomy-and-physiology/pages/11-3-axial-muscles-of-the-head-neck-and-back.
[5] J.G. Betts, K.A. Young, J.A. Wise, E. Johnson, B. Poe, D.H. Kruse, O. Korol, J.E. Johnson, M. Womble, and P. DeSaix. Bones of the Lower Limb. OpenStax, 2013. URL: https://openstax.org/books/anatomy-and-physiology/pages/8-4-bones-of-the-lower-limb.
[6] J.G. Betts, K.A. Young, J.A. Wise, E. Johnson, B. Poe, D.H. Kruse, O. Korol, J.E. Johnson, M. Womble, and P. DeSaix. Appendicular Muscles of the Pelvic Girdle and Lower Limbs. OpenStax, 2013. URL: https://openstax.org/books/anatomy-and-physiology/pages/11-6-appendicular-muscles-of-the-pelvic-girdle-and-lower-limbs.
[7] J.G. Betts, K.A. Young, J.A. Wise, E. Johnson, B. Poe, D.H. Kruse, O. Korol, J.E. Johnson, M. Womble, and P. DeSaix. Skeletal Muscle. OpenStax, 2013. URL: https://openstax.org/books/anatomy-and-physiology/pages/10-2-skeletal-muscle.
[8] Jack A. Rall. What makes skeletal muscle striated? Discoveries in the endosarcomeric and exosarcomeric cytoskeleton. Advances in Physiology Education, 42(4):672–684, dec 1 2018. URL: http://dx.doi.org/10.1152/advan.00152.2018, doi:10.1152/advan.00152.2018.
[9] H.L. Granzier and S. Labeit. The giant muscle protein titin is an adjustable molecular spring. Exercise and Sport Sciences Reviews, 34(2):50–53, 2006.
[10] J.G. Betts, K.A. Young, J.A. Wise, E. Johnson, B. Poe, D.H. Kruse, O. Korol, J.E. Johnson, M. Womble, and P. DeSaix. Muscle Fiber Contraction and Relaxation. OpenStax, 2013. URL: https://openstax.org/books/anatomy-and-physiology/pages/10-3-muscle-fiber-contraction-and-relaxation.
[11] J.G. Betts, K.A. Young, J.A. Wise, E. Johnson, B. Poe, D.H. Kruse, O. Korol, J.E. Johnson, M. Womble, and P. DeSaix. Nervous System Control of Muscle Tension. OpenStax, 2013. URL: https://openstax.org/books/anatomy-and-physiology/pages/10-4-nervous-system-control-of-muscle-tension.
[12] M.F. Schneider and E.O. Hernández-Ochoa. Skeletal Muscle Excitation–Contraction Coupling, pages 811–821. Volume 2. Elsevier, 2012.
[13] M.A. Cavalcanti Garcia and T.M.M. Vieira. Surface electromyography: why, when and how to use it. Revista Andaluza de Medicina del Deporte, 4(1):17–28, 2011. URL: https://www.redalyc.org/articulo.oa?id=323327665004.
[14] John Lazarevic. Spike Recorder for PC/Mac/Linux. Backyard Brains Docs, 2020. URL: https://help.backyardbrains.com/support/solutions/articles/43000607420-spike-recorder-for-pc-mac-linux.

Esta obra está bajo una Licencia Creative Commons Atribución 4.0 Internacional


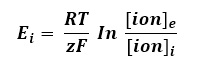
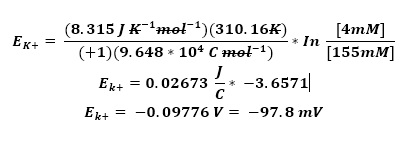
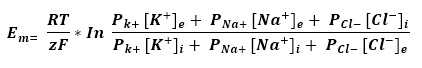




Comentarios recientes