Estudio de la actividad eléctrica del corazón. Fundamentos biofísicos del electrocardiograma.
Objetivo de aprendizaje
El estudiante:
- Describe los fenómenos eléctricos que se pueden valorar en el registro electrocardiográfico e interpreta lo observado en un ECG normal.
Resultado de aprendizaje
- Aprender a colocar el montaje de las derivaciones de un ECG en un compañero de clase.
- Describe la rutina de interpretación de ECG en clase.
- Interpreta un trazo electrocardiográfico normal de un compañero de clase.
Glosario de términos
Derivación electrocardiográfica: Terminal electrocardiográfica constituida por dos electrodos que recogen la diferencia de potencial generada por la actividad eléctrica cardiaca en esos dos puntos.
Las derivaciones electrocardiográficas pueden ser bipolares, en el caso de recoger la diferencia de potencial entre dos electrodos situados en determinadas regiones del cuerpo, o monopolares, cuando registran la diferencia de potencial existente entre un electrodo indiferente, con potencial nulo, y un electrodo situado en una determinada posición.
Según el plano que examinan, se dividen en derivaciones del plano frontal o derivaciones de miembros, con sus electrodos colocados en miembros superiores e inferiores, y derivaciones del plano horizontal o derivaciones precordiales, con sus electrodos en la pared torácica anterolateral.
Derivaciones del plano frontal:
Derivaciones monopolares: aVR, aVL, aVF
Derivaciones bipolares: DI, DII y DIII
Derivaciones precordiales: V1, V2, V3, V4, V5 y V6
Electrocardiograma: Registro de la actividad eléctrica del corazón.
- Introducción
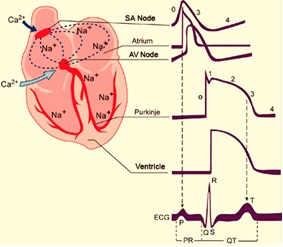
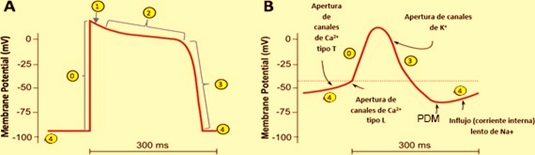
El músculo cardiaco es un tejido excitable capaz de contraerse al recibir un impulso por encima del potencial umbral. Las corrientes iónicas corren entre las células a través de uniones gap, puentes de baja resistencia que permite el flujo del potencial de una célula a otra. Las células cardíacas se comportan como una sola, así que toda contracción inicia con un potencial de acción en las células atriales para terminar en las células ventriculares.
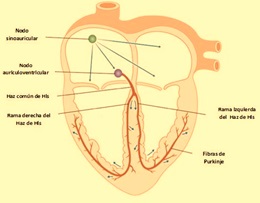
En condiciones normales, la generación del impulso eléctrico se origina en el nodo sinoatrial (SA), el cual se propaga por los 3 haces internodales hasta alcanzar el nodo atrioventricular (AV), después de un retraso de aproximadamente 100 ms, continúa por el haz de His y las fibras de Purkinje, que lo distribuyen hacia todo el miocardio ventricular para poder producir la sístole ventricular. Conforme el impulso se propaga por el corazón, la membrana de las células se despolariza y repolariza, lo que genera dipolos eléctricos: regiones con diferencias de carga en la superficie de las células separadas por cierta distancia. Los dipolos individuales se suman y generan vectores eléctricos generales que tienen magnitud, dirección y sentido. Estos vectores representan corrientes que se conducen fácilmente por el líquido extracelular y que podemos registrar en la superficie del cuerpo. El ECG es la gráfica de estas corrientes respecto al tiempo.
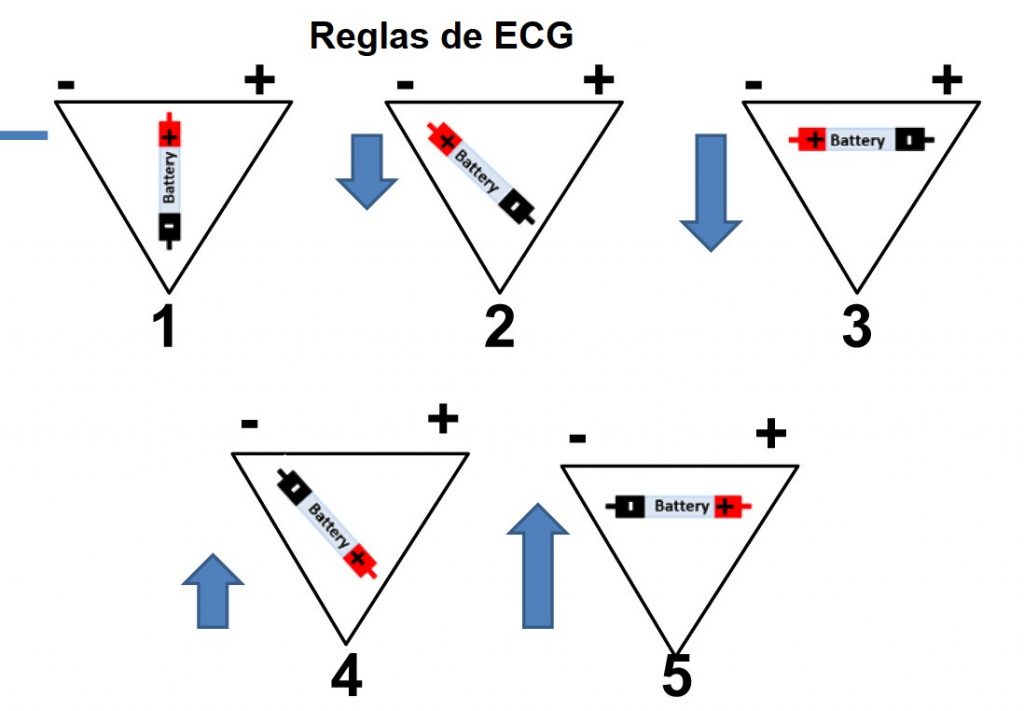
Figura 1. Cinco reglas de electrocardiograma (ECG) para comprender los vectores cardíacos.
1.1 Vectores cardíacos
Para poder comprender estos conceptos biofísicos complejos, se puede utilizar como analogía el funcionamiento de una batería en comparación con el sistema de conducción cardíaco.
Pero ¿cómo funciona una batería? Las baterías consisten en un sistema de separación de cargas negativas y positivas, y con ello una diferencia de potencial eléctrico entre ambos polos de la batería. Ciertas reacciones químicas son las que permiten acumular electrones en la terminal negativa [electrón = carga negativa (-)] de la batería, lo que resulta en una diferencia eléctrica entre el polo negativo y el positivo. Dicha acumulación de electrones es inestable, éstos últimos tratan de eliminar la diferencia de potencial entre los polos; chocan entre ellos y tienden a moverse a un lugar con menos electrones. Y el único lugar al que pueden ir los electrones es al polo positivo. Para que esto funcione el circuito debe cerrarse. Colocando la batería en un recipiente con agua salina, ambos polos se conectan. Es como si se colocara un cable entre el extremo positivo y el negativo.
La analogía va cobrando sentido cuando observamos que el corazón está inmerso en un líquido extracelular compuesto principalmente por agua y sodio. Esto simularía al recipiente de agua salina. Cuando se genera un potencial de acción en el nodo sinoatrial, los atrios forman un dipolo eléctrico, lo que genera diferencias de voltaje en el agua salina que se encuentra alrededor, y dicho proceso puede ser detectado por un voltímetro. Los electrodos que se colocan en la superficie corporal de un individuo pueden detectar la diferencia de voltaje en el líquido extracelular, que se generó por las despolarizaciones a través de los atrios y los ventrículos. El registro de esta diferencia de cargas entre dos polos es lo que llamamos electrocardiograma.
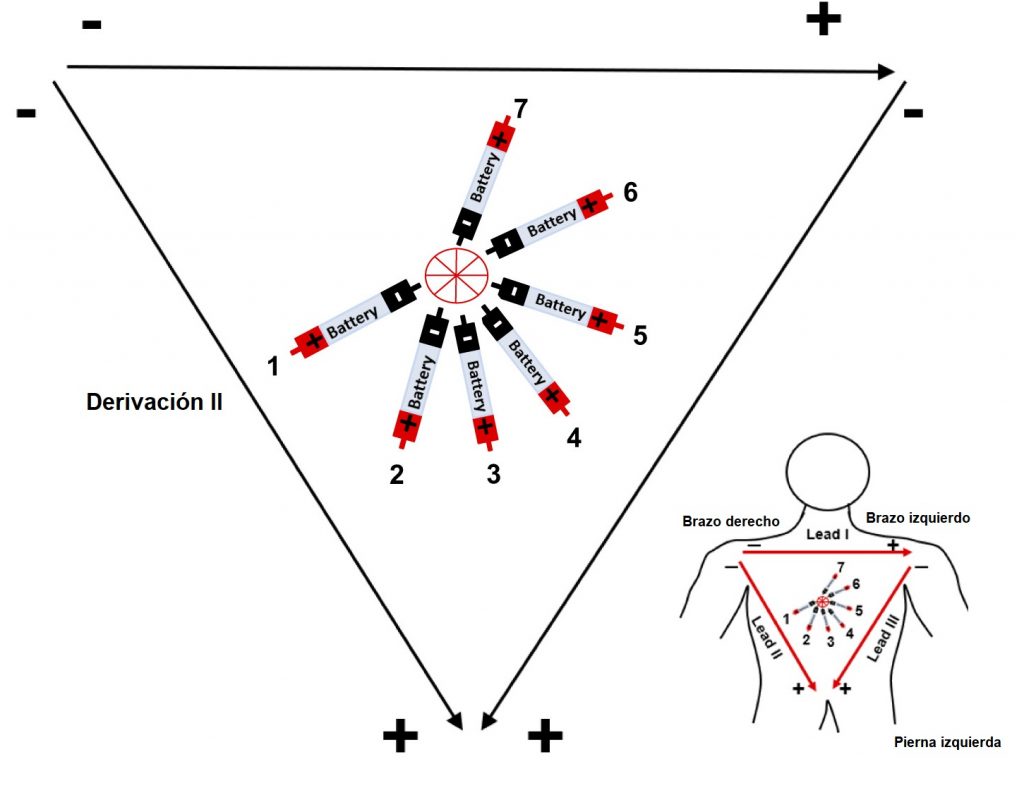
Willem Einthoven, fisiólogo ganador del premio Nobel de Medicina y Fisiología en 1924, revolucionó la manera en la que estudiamos la actividad eléctrica del corazón. Describió 3 principales derivaciones bipolares colocadas como se muestra en la imagen, para formar un triángulo, conocido hasta la actualidad como “Triángulo de Einthoven” y así estudiar desde diferentes puntos de vista al tejido cardiaco. La derivación DI, se coloca con el electrodo negativo en el lado derecho del cuerpo (brazo derecho), y el electrodo positivo en el lado izquierdo del cuerpo (brazo izquierdo), formando la parte superior del triángulo. La derivación DII, registra el voltaje eléctrico desde el lado derecho, hacia la parte inferior del cuerpo (pierna izquierda). Finalmente, la derivación DIII, completa el triángulo registrando desde el lado izquierdo hacia el extremo inferior. Hay que considerar la importancia de dichos vectores de estudio, observe que el lado izquierdo del cuerpo comparte electrodos negativos y electrodos positivos, por lo que su estudio dependerá de la derivación que se esté registrando.
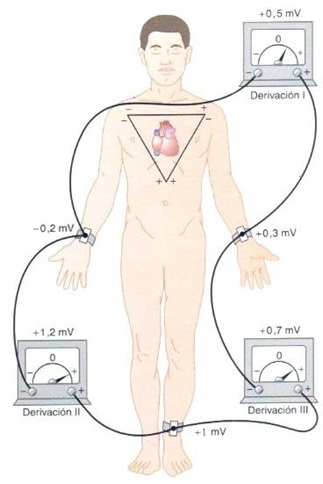
Figura 2. Triángulo de Einthoven
2. Actividades en la sesión
2.1 Actividad 1
En las siguientes imágenes se muestra el triángulo de Einthoven con 7 baterías dentro de él en diferente ángulo, simulando los vectores de despolarización en el tejido cardíaco. Con la información proporcionada en la introducción de la práctica, dibuje cómo se registrarán las diferencias de voltaje según la derivación (DI, DII, DIII) al ir cambiando la dirección del dipolo (Batería 1-7). Considere que cada segundo la batería cambia de posición (la batería 1 corresponde al segundo 1, la batería 2 al segundo 2, etc.) y en cada nueva posición los electrodos hacen una medición del voltaje (se muestran los resultados obtenidos).
Derivación I
|
Tiempo (s) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Voltaje (u.a*) |
-0.6 |
-0.2 |
0.2 |
0.45 |
0.6 |
0.55 |
0.1 |
*u.a =unidades arbitrarias.
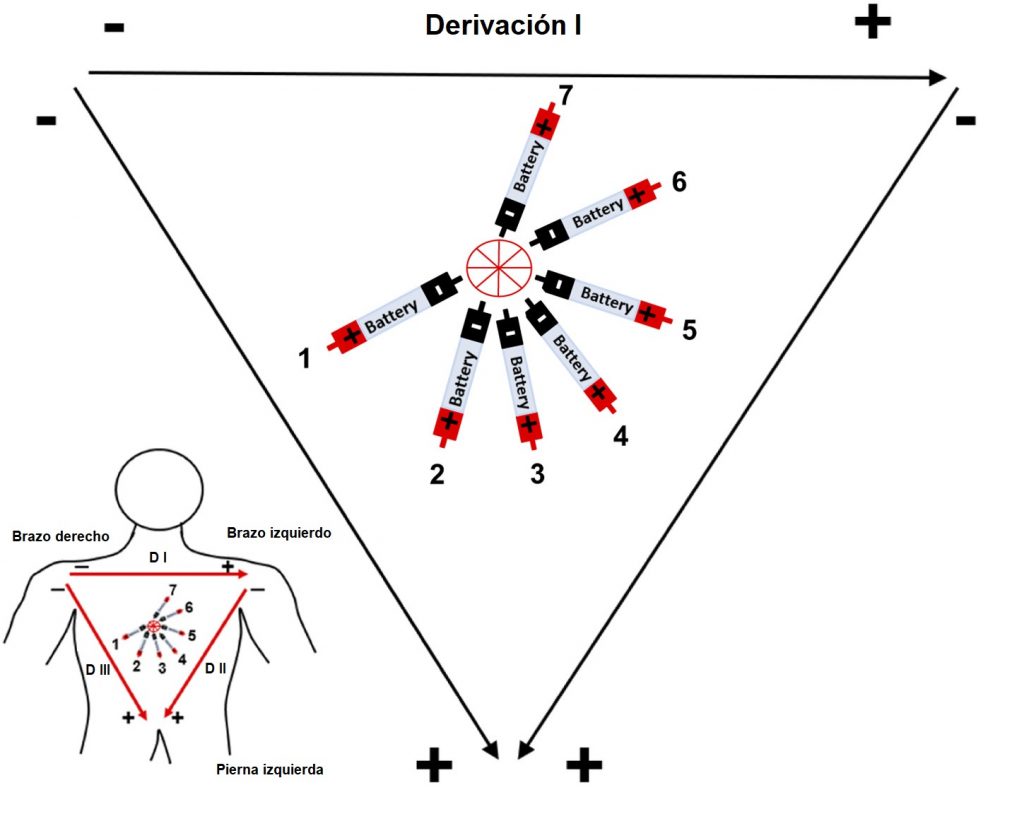
EJERCICIO: Dibuja la imagen que esperas registrar según el movimiento de cada batería
Derivación II
|
Tiempo (s) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Voltaje (u.a) |
-0.05 | 0.4 | 0.55 | 0.6 | 0.3 | 0.05 | -0.45 |
EJERCICIO: Dibuja la imagen que esperas registrar según el movimiento de cada batería

Derivación III
|
Tiempo (s) |
1 |
2 |
3 |
4 |
5 |
6 |
7 |
|
Voltaje (u.a) |
0.55 |
0.6 |
0.35 |
0.15 |
-0.3 |
-0.5 |
-0.55 |
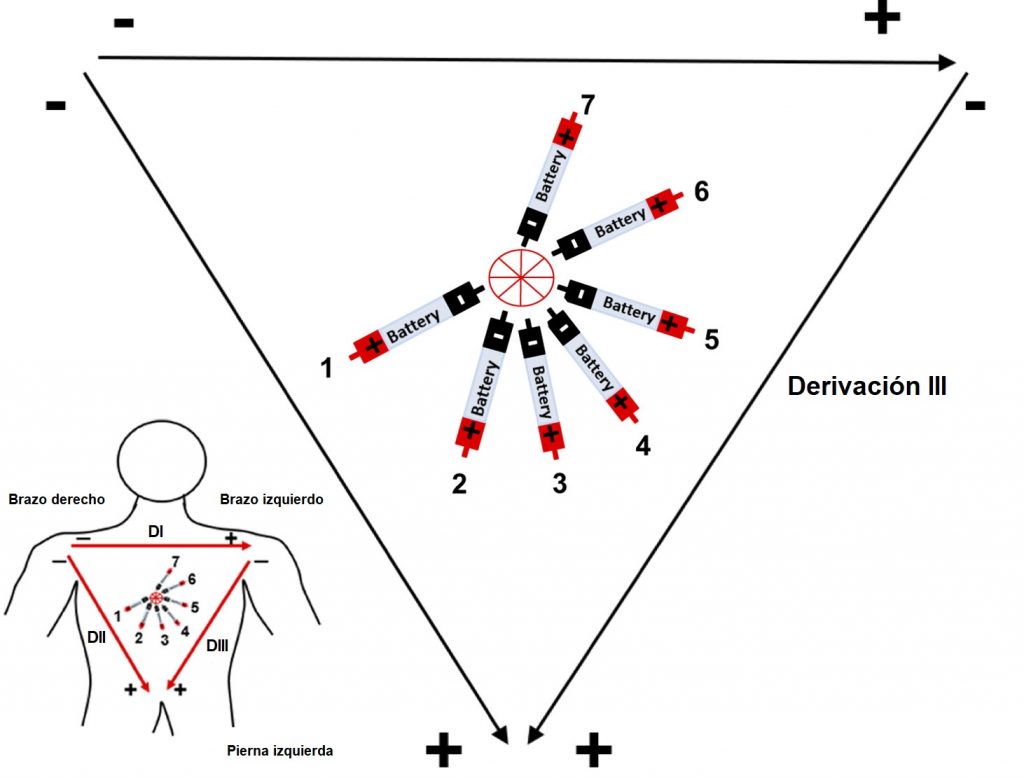
EJERCICIO: Dibuja la imagen que esperas registrar según el movimiento de cada batería

Basado en las gráficas obtenidas, deduce las reglas del electrocardiograma para entender los vectores cardíacos:
- Una onda despolarizante que viaja perpendicular al eje de un electrodo da una deflexión _______ con carga positiva y negativa de mismo voltaje.
2. Una onda despolarizante que se aleja de un electrodo resulta en una deflexión _______.
3. Una onda _______ que se aleja de forma paralela de un electrodo da como resultado una deflexión máxima negativa.
4. Una onda _______ que viaja hacia un electrodo resulta en una deflexión positiva en el trazo de ECG.
5. Una onda despolarizante que viaja hacia el electrodo de forma paralela da como resultado una deflexión máxima _______.
Discute durante la clase estas reglas y sus implicaciones. A continuación, contesta lo siguiente:
- Explica cómo aplicarías estas reglas a las ondas repolarizantes.
- Si la despolarización ventricular (complejo QRS) es predominantemente positiva en DII, ¿qué significa que la onda T (repolarización ventricular) también sea positiva? ¿Cuál es la dirección de la despolarización y cuál la de la repolarización ventricular?
Actividad 2. Viñeta clínica
Indicaciones: responde las preguntas de forma individual o en equipo antes de avanzar.
Mario es un oficinista de 50 años, fumador crónico. Mientras se dirigía a su trabajo, experimentó un dolor intenso en el pecho y cayó inconsciente. Un transeúnte lo auxilió mientras otro llamaba a una ambulancia, la cual lo llevó al servicio de urgencias más cercano al lugar. En el hospital le diagnosticaron un infarto agudo al miocardio con elevación del segmento ST (IAMCEST) y se le aplicó una intervención coronaria percutánea (ICP) para reperfundir el músculo cardíaco. Durante el pase de visita del día siguiente, Alfonso, estudiante de pregrado, revisa el electrocardiograma del día anterior y nota la elevación del segmento ST en las derivaciones V2, V3 y V4.
Alfonso recuerda que los cardiomiocitos tienen un potencial de membrana negativo (de alrededor de -90 mV) generado por gradientes iónicos, los cuales son mantenidos por la Na/K-ATPasa. Entonces, hace una suposición: durante la isquemia, el músculo cardíaco no dispone de los nutrimentos necesarios para mantener esa polaridad, por lo que se despolariza.
- ¿En algún momento crees que todo el músculo ventricular, tanto el tejido isquémico como el que no lo está, esté despolarizado?
Alfonso le plantea sus ideas al médico residente de cardiología, quien le explica que durante el segmento ST, particularmente en un punto al final del complejo QRS (punto J), todo el músculo ventricular se encuentra despolarizado (el tejido sano se despolariza debido al potencial de acción cardíaco, mientras que el tejido isquémico ya lo estaba debido a la carencia de nutrimentos). Luego, el médico residente le plantea a Alfonso la siguiente pregunta:
- Cuando el tejido sano se repolariza, ¿crees que el medio extracelular de la zona infartada será negativo o positivo con respecto al tejido sano?
Mientras el músculo ventricular sano se encuentra polarizado, la diferencia de voltaje existente con el medio extracelular del tejido isquémico y del tejido sano genera un vector o corriente de lesión. Por convención, en los vectores cardíacos la punta de flecha tiene dirección positiva. Al terminar de explicar lo anterior, el médico residente le pregunta a Alfonso:
- ¿El vector resultante del infarto apunta hacia el tejido isquémico o hacia el tejido sano?
Al día siguiente, al reflexionar sobre el tema y apoyándose en la explicación del residente, Alfonso se da cuenta de que el punto J es el potencial de referencia cero, por lo que no es que el segmento del ST esté elevado, sino que el resto del electrocardiograma está deprimido. La diferencia de potencial entre el punto J y los segmentos isoeléctricos del resto del electrocardiograma sirvió para que Alfonso calculara la magnitud del vector, y las derivaciones que estaban alteradas le permitieron saber su dirección. Finalmente, presentó su conclusión al residente sobre la ubicación del infarto, el cual lo felicitó. Discute con tus compañeros y con la guía de tu profesor las siguientes preguntas:
- En Mario, ¿hacia dónde está apuntando el vector de lesión?
- ¿En qué parte del corazón se encuentra el infarto? ¿Cómo llegaron a esa conclusión?
- Basado en tus conocimientos de anatomía, ¿qué rama coronaria crees que pudo haberse obstruido?
3. Referencias
- Actividad basada en: Lujan, H. L., Wellette-Hunsucker, A. y DiCarlo, S. E. (2020). Electrify your class with a simple battery: battery demonstration of electrocardiogram vectors. Advances in physiology education, 44(3), 394–399. https://doi.org/10.1152/advan.00055.2020
- Hall, J. E y Hall, M. E. (2021). Guyton y Hall. Tratado de fisiología médica. 14a edición. Barcelona: Elsevier.
Taller de ECG
-
-
-
-
-
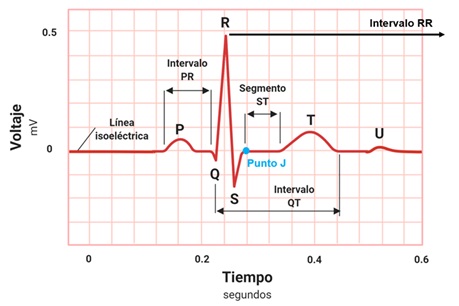
- El electrocardiograma es un estudio de gabinete que registra el voltaje generado por los vectores de despolarización y repolarización de las células cardiacas en relación con el tiempo. Dicha actividad eléctrica adquiere una morfología muy particular que depende en gran medida de la localización de la derivación que se estudie y si ésta es bipolar o monopolar.Para poder interpretar correctamente un electrocardiograma, es fundamental conocer los elementos que lo integran y su significado (ver figura 1). Está compuesto por: 1) Ondas; que representan el cambio en el voltaje en el líquido extracelular que rodea a las células cardíacas. Estas ondas son generadas por los vectores despolarización o repolarización de alguna zona del corazón, y será positivo o negativo su registro en el electrocardiograma según la derivación que se estudie. 2) Intervalos; los cuales incluyen una onda y un segmento isoeléctrico. 3) Segmentos; no muestran ningún cambio en el voltaje, es decir, en una o un paciente sin enfermedad, debe ser isoeléctrico. No incluyen ninguna onda. 4) Complejos; son la agrupación de diferentes ondas. Sirven para estudiar integralmente algún fenómeno y no solo un vector.
- Onda P. Corresponde a la despolarización auricular. Es la suma de los vectores de despolarización auricular derecha y el de despolarización auricular izquierda.
- Intervalo PR. Representa el tiempo transcurrido desde la despolarización auricular, hasta la despolarización ventricular. Debido a que es un intervalo, incluye la onda P y el segmento PR. Éste último elemento es una línea isoeléctrica, establecida gracias al retardo fisiológico que sufre la conducción eléctrica en el nodo aurículoventricular. Sin este retraso mencionado, las aurículas y los ventrículos se despolarizarían casi al mismo tiempo, siendo imposible el funcionamiento correcto del corazón para que la sangre pase por sus diferentes cavidades ordenadamente.
- Onda Q. Muestra el inicio de la despolarización ventricular. Específicamente representa el primer vector de despolarización, denominado vector de despolarización septal. Dicho vector se dirige de izquierda a derecha, de arriba a abajo y de atrás hacia adelante.
- Onda R. Al igual que la onda anterior, la onda R es parte del registro de la despolarización ventricular. Solo que ahora representa al segundo vector de despolarización, o vector de la pared libre del ventrículo izquierdo. Es normalmente la onda con mayor voltaje, debido a que el ventrículo izquierdo es el que mayor cantidad de células posee, por ende, la actividad eléctrica es mayor y el vector es más grande. Su dirección es de derecha a izquierda, de arriba hacia abajo y de atrás a adelante.
- Onda S. Corresponde al último vector de despolarización ventricular, el cual es originado en las bases de los ventrículos, o masas paraseptales altas. Se dirige de abajo hacia arriba, de izquierda a derecha y de adelante hacia atrás.
- Complejo QRS. Es la suma de los tres vectores de despolarización anteriores, y juntos representan a la despolarización ventricular.
- Segmento ST. Es un periodo de inactividad que separa la despolarización ventricular de la repolarización ventricular. Normalmente es isoeléctrico y va desde el final del complejo QRS hasta el comienzo de la onda T. Al punto de unión entre el final del complejo QRS y el segmento ST se le denomina punto J (punto azul en la Figura 1). Esto sirve para identificar cuando un segmento ST está desnivelado con respecto a la línea isoeléctrica, hecho característico de enfermedades isquémicas del corazón.
- Intervalo QT. Se extiende desde el comienzo del complejo QRS hasta el final de la onda T y representa la sístole eléctrica ventricular, o lo que es lo mismo, el conjunto de la despolarización y repolarización ventricular. La medida de este intervalo depende de la frecuencia cardiaca, de forma que el intervalo QT se acorta cuando la frecuencia cardiaca es alta, y se alarga cuando la frecuencia cardiaca es baja. Por lo anterior, cuando se mide, es necesario corregirlo de acuerdo con la frecuencia cardíaca utilizando la fórmula de Bazett (QT no corregido, entre la raíz cuadrada del intervalo RR):
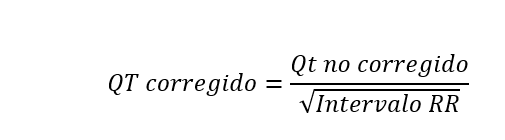
- Onda T. Es la onda que representa la repolarización ventricular.
- Onda U. Es una onda de escaso voltaje que puede o no estar presente en el trazado del electrocardiograma. Se debe a la repolarización de los músculos papilares.
- Intervalo RR. Es el intervalo que abarca desde una onda R, hasta la onda R de la siguiente despolarización, es decir dos ondas R sucesivas. En un paciente sin enfermedad, debe permanecer a un ritmo constante. La medida de este intervalo dependerá de la frecuencia cardiaca.
Figura 1. Elementos del electrocardiograma.
Ahora bien, una vez descritas todas las ondas, segmentos, intervalos y complejos del electrocardiograma, es necesario conocer las características del papel milimétrico en el que se imprime. Esto es importante debido a que una mala calibración puede llevar a interpretaciones y diagnósticos erróneos.
El papel electrocardiográfico es una cuadrícula milimétrica tanto en sentido horizontal como en sentido vertical. Cada 5 mm las líneas de la cuadrícula se hacen más gruesas, quedando así marcados cuadrados grandes de 5 mm x 5 mm y cuadrados chicos de 1 mm x 1 mm. Horizontalmente, el papel de registro corre a una velocidad constante de 25 mm/seg, por lo que cada milímetro equivale a 0.04 segundos o 40 milisegundos, y un cuadrado grande a 0.20 segundos o 20 milisegundos. Verticalmente se mide el voltaje o amplitud de los elementos del electrocardiograma. La calibración convencional establece que 1 cm de amplitud equivale a 1 mV, por lo que 1 mm es igual a 0.1 mV y un cuadrado grande de 5 mm a 0.5 mV (ver Figura 2). La calibración anteriormente descrita es la más utilizada, sin embargo, se puede calibrar con valores diferentes según las necesidades del médico o médica tratante. Esto es importante, ya que lo primero que se debe revisar en un electrocardiograma es la calibración a la que está ajustado, de lo contrario toda la interpretación posterior podría ser incorrecta.
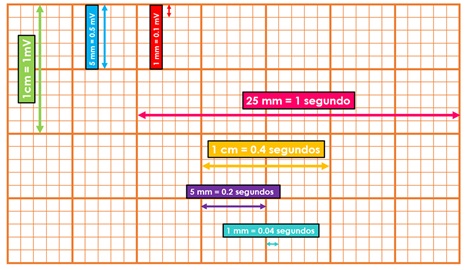
Figura 2. Calibración del electrocardiograma
El electrocardiograma convencional consta de 12 derivaciones. 6 de ellas estudian al corazón en un plano frontal y las 6 restantes en un plano horizontal. Las derivaciones frontales se pueden subdividir de la siguiente manera: 3 derivaciones bipolares y 3 monopolares. Las 6 horizontales son de tipo monopolar.
Las 3 derivaciones frontales bipolares requieren dos electrodos, para así registrar la diferencia de potencial eléctrico entre ambos, de ahí que se denominen “bipolares”. En el electrocardiograma se les conoce como DI, DII y DIII. Estas derivaciones, revisadas en la práctica 1 “Fundamentos biofísicos del electrocardiograma”, son las originalmente descritas por Willem Einthoven, y juntas forman el característico “Triángulo de Einthoven”.
Frank Norman Wilson, reconocido cardiólogo estadounidense, basándose en los conocimientos descritos por Einthoven comenzó a desarrollar las 3 derivaciones frontales monopolares. Para su registro unió las tres derivaciones del triángulo de Einthoven, cada una a través de una resistencia de 5000 Ω a un punto o central terminal de Wilson donde el potencial eléctrico era cercano a cero. Esta central terminal se conectaba a un aparato de registro del que salía el electrodo explorador, el cual toma el potencial absoluto (V) en el brazo derecho (VR), el brazo izquierdo (VL) y la pierna izquierda (VF). Cabe recordar que para darle nombre a las derivaciones se utiliza el idioma inglés, por lo que “R” es right, “L” es left y “F” es foot.
Posteriormente Goldberger, modificó el sistema propuesto por Wilson, consiguiendo aumentar así la amplitud de las ondas hasta en un 50%, de aquí que a estas derivaciones se les llamen aVR, aVL y aVF, donde la letra “a” significa ampliada o aumentada.
Finalmente, las derivaciones horizontales, conocidas también como precordiales, igualmente se obtienen utilizando el sistema propuesto por Wilson, es decir, uniendo las derivaciones de los miembros a través de resistencias de 5000 Ω a una central terminal, de donde sale un electrodo explorador que va a colocarse en el precordio (ver figura 3).
Como se mencionó con anterioridad, las derivaciones precordiales son 6, y se colocan de la siguiente manera en el o la paciente:
- V1. Intersección del 4to espacio intercostal derecho con la línea paraesternal derecha.
- V2. Intersección del 4to espacio intercostal izquierdo con la línea paraesternal izquierda.
- V3.. A la mitad de distancia entre V2 y V4.
- V4. Intersección del 5to espacio intercostal izquierdo y la línea medioclavicular izquierda.
- V5. Intersección del 5to espacio intercostal izquierdo y la línea axilar anterior izquierda.
- V6. Intersección del 5to espacio intercostal izquierdo y la línea axilar media izquierda.
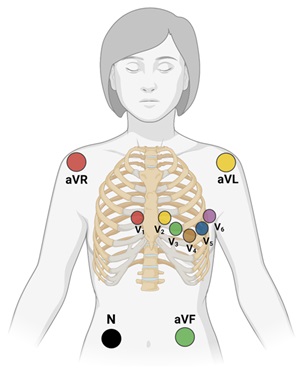
Figura 3. Colocación correcta de los 10 electrodos necesarios para un electrocardiograma de 12 derivaciones (4 para derivaciones frontales, 6 para derivaciones horizontales o precordiales).
Nótese que el electrodo “N”, sirve como toma a tierra, evitando así alteraciones en el registro de los demás. Convencionalmente este electrodo se coloca en la pierna derecha.
Bailey desplazó los tres lados que componen el triángulo de Einthoven, de manera que pasen por el centro del corazón, obteniendo así un sistema de tres ejes (Sistema triaxial de Bailey) en el plano frontal. Si se toman en cuenta además las derivaciones descritas por Wilson (frontales monopolares) el sistema anterior queda dividido en seis ejes, constituyendo el sistema hexaxial de Bailey.
Es importante recordar que cada derivación tiene un extremo positivo y uno negativo, por lo que al formar el sistema hexaxial de Bailey en un círculo de 360°, cada extremo de las derivaciones corresponderá a un valor establecido en grados (ver figura 4).
El extremo positivo de DI se sitúa a 0° y el negativo a 180°, dividiendo al corazón en una parte inferior y en una superior. La parte inferior de esta división abarcará desde 0° hasta +179°, es decir, grados positivos. Por su parte, el extremo superior contendrá desde 0° hasta -179°, en otras palabras, grados negativos.
El extremo positivo de DII se sitúa en +60°, mientras que el negativo en -120°; el lado positivo de DIII tendrá un valor de +120, y el negativo de -60°. Hasta ahora, solo se ha descrito el sistema triaxial de Bailey, en el que se puede encontrar un eje cada 60°.
El extremo positivo de aVR se dirige hacia -150° , mientras que el negativo se sitúa en +30°. El polo positivo de aVL equivale a -30°, y el negativo a +150°. Finalmente aVF, cuyo extremo positivo señala hacia +90° y el negativo a -90°. Así es como obtenemos el sistema hexaxial de Bailey, encontrando un eje cada 30°.
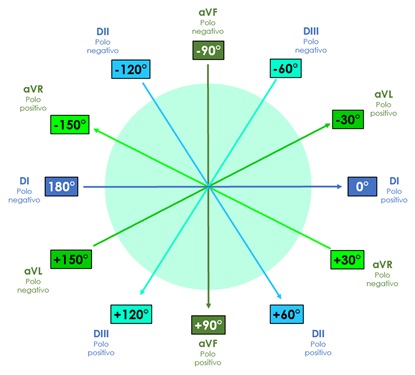
Figura 4. Sistema hexaxial de Bailey
ELECTROCARDIOGRAMA NORMAL
El electrocardiograma estándar debe interpretarse siguiendo una secuencia ordenada de pasos. Los elementos básicos a analizar son:
- Ritmo (sinusal o no sinusal)
- Frecuencia cardíaca (en latidos por minuto, lpm)
- Eje cardíaco (en grados)
- Análisis de ondas, segmentos e intervalos
- Búsqueda de anormalidades
Puedes recordar estos pasos usando la mnemotecnia FRESA: F (frecuencia), R (ritmo), E (eje cardíaco), S (segmentos, ondas e intervalos), A (anormalidades).
- Ritmo
Debe clasificarse como sinusal o no sinusal. Los criterios de un ritmo sinusal son:
- Ondas P de morfología normal positivas en DII, DIII y aVF, y negativas en aVR (lo cual indica que la despolarización auricular se dirige hacia abajo y hacia la izquierda, por lo que el estímulo se origina en el nodo sinusal).
- Frecuencia cardíaca entre 60 y 100 latidos por minuto, que es la frecuencia de descarga intrínseca del nodo sinusal. El intervalo RR debe ser regular.
- Todo complejo QRS debe estar precedido por una onda P, lo cual nos dice que cada despolarización ventricular se antecede de una despolarización de las aurículas (previamente determinamos que esta despolarización se originó en el nodo sinusal).
La presencia de todos los criterios anteriores son fuertes indicativos de un ritmo cardíaco generado en el nodo sinusal y propagado por el sistema de conducción de manera normal. Cuando el único criterio que no está presente es una frecuencia cardíaca entre 60 y 100 latidos por minuto, hablamos de bradicardia sinusal (cuando la frecuencia cardíaca es menor a 60 lpm) o taquicardia sinusal (cuando es superior a 100 lpm)
2.Frecuencia cardíaca
Existen varios métodos para calcular la frecuencia cardíaca. Todos ellos se basan en que la frecuencia cardíaca es el inverso del intervalo RR y en la calibración del electrocardiograma, en donde 25 mm equivalen a 1 segundo. El inverso de un número X es 1/X, por lo que el inverso de una frecuencia cardíaca de 80 latidos por minuto (80 latidos/60 segundos) es 60/80 = 0.75 segundos (el valor del intervalo RR para una frecuencia cardíaca de 80 lpm). El mismo proceso se puede llevar a cabo despejando la frecuencia cardíaca cuando el valor conocido es el intervalo RR, con lo que 60/0.75 = 80 lpm. Por lo tanto, un minuto (60 segundos) dividido entre el intervalo RR (en segundos) resulta en el valor de la frecuencia cardíaca (en latidos por minuto). A esta fórmula única le podemos dar varias formas para obtener una aproximación más rápida o más exacta, según se requiera:
- Método de los cuadros chicos
Cada cuadro chico equivale a 0.04 segundos, por lo que un minuto es igual a 1,500 cuadrados chicos (60/0.04 = 1,500). De este modo, si la frecuencia cardíaca es igual a un minuto dividido entre el intervalo RR, entonces dividiendo 1,500 entre el intervalo RR (expresado en número de cuadros chicos) obtenemos la frecuencia cardíaca en latidos por minuto.
1,500/intervalo RR en cuadros chicos = FC
Este método es muy exacto, pues utiliza la medida temporal más baja posible que permite la calibración estándar del electrocardiograma: 0.04 segundos.
- Método de los cuadros grandes
Cada cuadrado grande equivale a 0.2 segundos. Por lo tanto, un minuto equivale a 300 cuadrados grandes. De este modo, dividir 300 entre el número de cuadrados grandes que hay entre una onda R y la siguiente, equivale a la frecuencia cardíaca:
300/intervalo RR en cuadros grandes = FC
Puedes observar que este es un método más sencillo, pero más inexacto que el anterior. Funciona mejor si una onda R cae en una línea gruesa y la siguiente también. Puedes usarlo para aproximarte rápidamente a la frecuencia cardíaca.
- Método “rápido”
Deriva del método anterior. Surge de dividir 300 entre 1, 2, 3, 4, 5 y 6. Los números resultantes (300, 150, 100, 75, 60 y 50, respectivamente) pueden memorizarse, y al tener un electrocardiograma en las manos podemos contar de manera descendente por cada cuadro grande desde una onda R hasta la siguiente. Por ejemplo, si la onda R siguiente a la que se muestra en la figura 5 se encontrara 4 cuadros grandes adelante, sabríamos que la frecuencia cardíaca es de 75 lpm. En la misma figura, puedes observar que cuando el intervalo RR mide entre 3 y 5 cuadros grandes, la frecuencia cardíaca está en un rango normal (entre 60 y 100 lpm), lo cual puede ser una comprobación rápida de que no existe bradicardia o taquicardia.
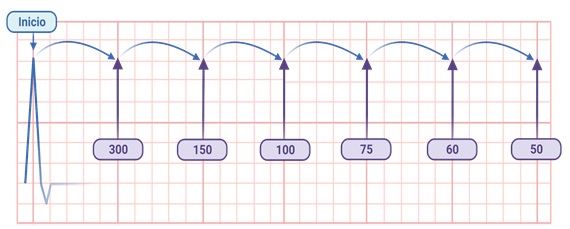
Figura 5. Cálculo de la frecuencia cardiaca con el método “rápido”
- Método para un ritmo irregular
Cuando el ritmo cardíaco es irregular (es decir, cuando el intervalo RR no es constante) no tiene mucho sentido obtener la frecuencia cardíaca a partir de un único intervalo RR, porque podríamos sobreestimar o subestimar enormemente la frecuencia cardíaca (y el valor obtenido carecería de utilidad). La solución más práctica a esto es contar los complejos QRS que existen en una medida de tiempo y multiplicarlo por un factor que nos arroje la frecuencia cardíaca en 60 segundos. Concretamente, si contamos los complejos QRS que hay en 30 cuadrados grandes (6 segundos) y lo multiplicamos por 10, obtenemos un aproximado útil de la frecuencia cardíaca.
3. Eje Cardiaco
El eje cardíaco representa el vector total de despolarización ventricular; es decir, es el promedio de los vectores de despolarización (mostrados en la Figura 6) registrados en el complejo QRS. Cada una de las derivaciones muestra su propio “punto de vista” del eje cardíaco, y el vector resultante normalmente apunta hacia abajo y hacia la izquierda. Conocer el eje cardíaco es muy importante, pues aporta información sobre la conducción ventricular (por ejemplo, puede desviarse en un bloqueo de rama del haz de His), el grosor de las paredes ventriculares (por ejemplo, en una hipertrofia del ventrículo izquierdo) e incluso la posición del corazón en el tórax (por ejemplo, en una persona con “verticalización” cardíaca debido a atrapamiento aéreo por una neumopatía). Si comprendiste el tema de descomposición (análisis) vectorial, sabrás que a partir de cualquier par de derivaciones frontales puede obtenerse el eje cardíaco; esto se debe a que si trazamos líneas perpendiculares desde el vector registrado en cada derivación, todas estas líneas se intersectan siempre en un único punto. Si bien podemos usar cualquier par de derivaciones, es más cómodo y preciso usar dos derivaciones perpendiculares entre sí. Por ejemplo, podemos usar aVF y DI. Al trazo del vector total de despolarización ventricular a partir de los registros de dos derivaciones (usando la intersección de las líneas perpendiculares) se le llama método geométrico.
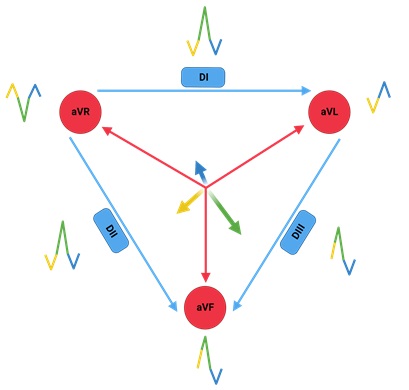
- Figura 6. Vectores de despolarización ventricular y su representación en las 6 derivaciones frontales.
Sin embargo, no siempre tendrás una regla, un compás y papel milimétrico en un entorno clínico, por lo que conviene aprender otros métodos. Uno de los más usados y precisos es el método de la isodifásica. Se basa en que la derivación que tenga un QRS con un trazo isodifásico (es decir, el componente positivo del trazo es de igual magnitud al negativo) es perpendicular al eje cardíaco. Consta de los siguiente pasos:
- Identifica la derivación frontal que tiene un QRS isodifásico. El eje cardíaco es aproximadamente perpendicular a esta derivación.
- Ubica la derivación perpendicular a la que muestra el QRS isodifásico. El eje cardíaco tiene un ángulo parecido a esta derivación. Para ubicar rápidamente la derivación perpendicular, puedes usar la mnemotecnia FLoR, en donde aVF es perpendicular a DI, aVL a DII y aVR a DIII. Con este paso obtenemos la dirección del eje cardíaco.
- Observa si la derivación perpendicular tiene un trazo positivo o negativo. Si es positivo, se acerca al electrodo positivo de la derivación; si es negativo se aleja del electrodo positivo. Con este último paso obtenemos el sentido del eje cardíaco.
Una vez que conocemos el eje cardíaco, podemos determinar si es normal o se encuentra desviado. Un eje cardíaco normal se encuentra entre -30° y 120° en el sistema hexaxial de Bailey. Valores fuera de este rango indican una desviación del eje cardíaco, como lo muestra la Figura 7:
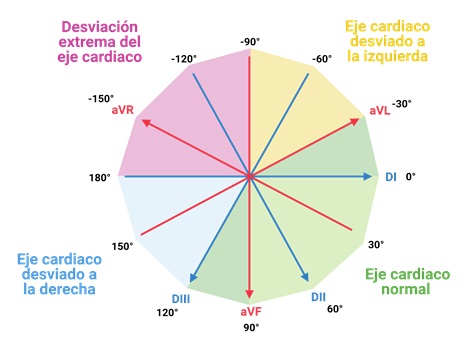
Figura 7. Interpretación del eje eléctrico cardíaco dentro del sistema hexaxial de Bailey.
Un consejo para verificar rápidamente si el eje cardíaco es normal es observar los complejos QRS de las derivaciones DI y aVF. Si en ambas derivaciones el trazo es positivo, el eje cardíaco se encuentra entre 0° y 90° (por lo que con toda certeza es normal).
4.Análisis de ondas, segmentos e intervalos
Este paso corresponde a medir la duración y amplitud de los componentes del trazo electrocardiográfico (ondas, segmentos e intervalos), mencionados anteriormente.
5.Búsqueda de anormalidades
Este punto no podría abordarse satisfactoriamente en un taller de una sesión y no corresponde a los objetivos de la materia, pero es preciso mencionarlo. El reconocimiento de patrones patológicos y la comprensión de su fisiopatología se verá a lo largo de tu formación médica; de momento, revisaremos algunos electrocardiogramas patológicos en la siguiente sección (lo cual reforzará tu capacidad de identificar un electrocardiograma normal).
- ACTIVIDAD/TALLER
Nota importante: Para realizar la actividad es necesario que te guies de la sección de la introducción titulada: “ELECTROCARDIOGRAMA NORMAL”.
- Con los conocimientos adquiridos en la práctica, realiza la interpretación de las siguientes viñetas clínicas. No olvides la secuencia de pasos a seguir para revisar integralmente el electrocardiograma de cada viñeta.
Caso 1
Se presenta ante usted Juan Carlos, paciente masculino de 51 años de edad, con sensación de opresión en el pecho y disnea que ha ido empeorando con el tiempo. Se refiere al servicio de urgencias en donde se le toma el siguiente electrocardiograma:
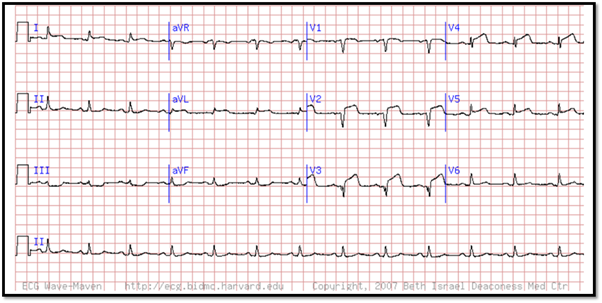
Con base en el trazo anterior analiza:
- Ritmo:
- Frecuencia cardiaca:
- Eje eléctrico:
- Ondas, segmentos, intervalos y complejos:
Responde lo siguiente:
- ¿Qué alteraciones encuentras en el electrocardiograma de Juan Carlos?
- Desde un abordaje funcional, ¿cuál es el proceso que se ha visto afectado?
Caso 2
Se presenta a su servicio Mónica, mujer de 18 años de edad, referida por su médico de atención primaria por haber detectado durante una exploración rutinaria una auscultación cardiaca con ritmo irregular. Motivo por el cual acude con usted con el siguiente electrocardiograma.
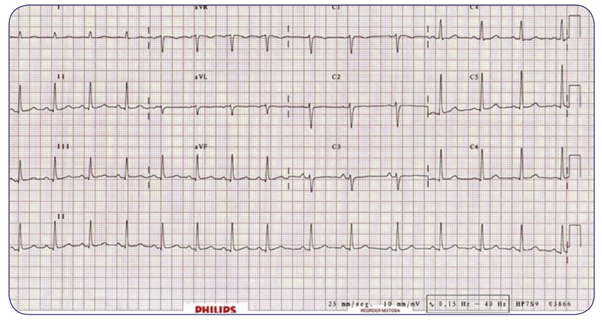
Con base en el trazo anterior analiza:
- Ritmo:
- Frecuencia cardiaca:
- Eje eléctrico:
- Ondas, segmentos, intervalos y complejos:
Responde lo siguiente:
- ¿Qué alteraciones encuentras en el electrocardiograma de Mónica?
- Desde un abordaje funcional, ¿cuál es el proceso que se ha visto afectado?
Caso 3
Se presenta ante usted Alondra, mujer de 42 años de edad. Menciona que le falta un poco el aire al realizar ejercicio y se cansa muy rápido, motivo por el cual se decide realizarle un electrocardiograma, encontrando lo siguiente:
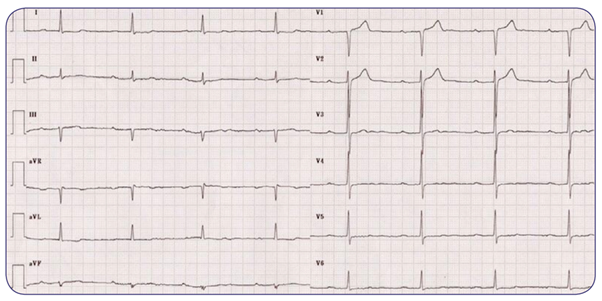
Con base en el trazo anterior analiza:
- Ritmo:
- Frecuencia cardiaca:
- Eje eléctrico:
- Ondas, segmentos, intervalos y complejos:
Responde lo siguiente:
- ¿Qué alteraciones encuentras en el electrocardiograma de Alondra?
- Desde un abordaje funcional, ¿cuál es el proceso que se ha visto afectado?
Diagnósticos de las viñetas clínicas
- Caso 1. Infarto agudo al miocardio con elevación del segmento ST.
- Caso 2. Arritmia sinusal respiratoria.
- Caso 3. Bloqueo aurículoventricular de primer grado.
REFERENCIAS
- El electrocardiograma es un estudio de gabinete que registra el voltaje generado por los vectores de despolarización y repolarización de las células cardiacas en relación con el tiempo. Dicha actividad eléctrica adquiere una morfología muy particular que depende en gran medida de la localización de la derivación que se estudie y si ésta es bipolar o monopolar.Para poder interpretar correctamente un electrocardiograma, es fundamental conocer los elementos que lo integran y su significado (ver figura 1). Está compuesto por: 1) Ondas; que representan el cambio en el voltaje en el líquido extracelular que rodea a las células cardíacas. Estas ondas son generadas por los vectores despolarización o repolarización de alguna zona del corazón, y será positivo o negativo su registro en el electrocardiograma según la derivación que se estudie. 2) Intervalos; los cuales incluyen una onda y un segmento isoeléctrico. 3) Segmentos; no muestran ningún cambio en el voltaje, es decir, en una o un paciente sin enfermedad, debe ser isoeléctrico. No incluyen ninguna onda. 4) Complejos; son la agrupación de diferentes ondas. Sirven para estudiar integralmente algún fenómeno y no solo un vector.
-
-
-
- Hall, J. E. y Hall, M. E. (2021). Guyton y Hall. Tratado de fisiología médica. 14a ed. Barcelona: Elsevier.
- Castellano C, Perez de Juan MA, Attie F (2004). Electrocardiografía clínica, segunda edición. España: Elsevier.
- Pérez E, Higueras J, Gómez JC, Martínez P (2017). Casos ECG de concurso. eCardio 2017. Sociedad Española de Cardiología. Casos 3 y 25.
-
Esta obra está bajo una
Licencia Creative Commons
Atribución 4.0 Internacional



Comentarios recientes